
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)=c(NH4+)>c(H+)=c(OH-) | D. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
分析 pH=2的盐酸的浓度为0.01mol/L,pH=12的氨水中氢氧根离子浓度为0.01mol/L,一水合氨为弱碱,溶液中只能部分电离出氢氧根离子,则氨水浓度远远大于0.01mol/L,两溶液等体积混合后溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒判断溶液中各离子浓度大小.
解答 解:氯化氢为强电解质,则pH=2的盐酸的浓度为0.01mol/L,
pH=12的氨水中氢氧根离子浓度为0.01mol/L,一水合氨为弱碱,溶液中只能部分电离,则氨水浓度远远大于0.01mol/L,
两溶液等体积混合后溶液显碱性,则:c(OH-)>c(H+),
根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,c(Cl-)<c(NH4+),
则混合液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故选B.
点评 本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,正确判断反应后溶质组成及溶液酸碱性为解答关键,注意掌握根据电荷守恒、盐的水解、物料守恒等知识判断溶液中离子浓度大小的方法.


科目:高中化学 来源: 题型:填空题

 +H2O;n HOCH2CH2OH+n HOOC-COOH
+H2O;n HOCH2CH2OH+n HOOC-COOH 
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
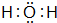 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -16Q kJ/mol | B. | +8Q kJ/mol | C. | +16 Q kJ/mol | D. | -8 Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 在电池放电的过程中,电解质溶液的碱性变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 金属铁与稀硝酸反应 Fe+2H+=Fe2++H2↑ | |
| C. | 在硅酸钠溶液中滴加稀硫酸 SiO32-+2H+=H2SO3↓ | |
| D. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-=Cu2++SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | Mg2+ | D. | Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com