
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

【答案】 ![]() 15 N sp2 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强 N2或CO 8 正四面体 12
15 N sp2 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强 N2或CO 8 正四面体 12 ![]() ×1030
×1030
【解析】试题分析:(1)基态氯原子的最外层有7个电子,排布在3s、3p能级上;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子;CO32-中碳原子的价电子对数是![]() ;(3) 水分子间氢键比氨分子间氢键强;(4)等电子体是原子数相同、价电子数相同的微粒;单键是σ键,三键中有1个是σ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图分析氯离子周围离氯离子最近的氯离子数目;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是
;(3) 水分子间氢键比氨分子间氢键强;(4)等电子体是原子数相同、价电子数相同的微粒;单键是σ键,三键中有1个是σ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图分析氯离子周围离氯离子最近的氯离子数目;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是![]() pm,根据均摊原则,每个晶胞含有 Clˉ数是
pm,根据均摊原则,每个晶胞含有 Clˉ数是![]() ,含有Na+数是
,含有Na+数是![]() ;
;
解析:(1)基态氯原子的价电子排布在3s、3p能级上,价电子排布图是![]() ;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1,排布在15个原子轨道上,所以有15种空间运动状态;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子,所以碳、氮、氧三种元素中第一电离能最大的是N;CO32-中碳原子的价电子对数是
;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1,排布在15个原子轨道上,所以有15种空间运动状态;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子,所以碳、氮、氧三种元素中第一电离能最大的是N;CO32-中碳原子的价电子对数是![]() ,所以碳原子的杂化轨道类型为sp2 ;(3) 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强,所以水的沸点高于液氨;(4)等电子体是原子数相同、价电子数相同的微粒,所以与CNˉ互为等电子体的分子的化学式是N2或CO;单键是σ键,三键中有1个是σ键,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图,1个氯离子周围离氯离子最近的氯离子数目是12个;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是
,所以碳原子的杂化轨道类型为sp2 ;(3) 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强,所以水的沸点高于液氨;(4)等电子体是原子数相同、价电子数相同的微粒,所以与CNˉ互为等电子体的分子的化学式是N2或CO;单键是σ键,三键中有1个是σ键,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图,1个氯离子周围离氯离子最近的氯离子数目是12个;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是![]() pm,根据均摊原则,每个晶胞含有 Clˉ数是
pm,根据均摊原则,每个晶胞含有 Clˉ数是![]() ,含有Na+数是
,含有Na+数是![]() ;所以密度是
;所以密度是![]()
![]() ×1030 g·cm-3。
×1030 g·cm-3。


科目:高中化学 来源: 题型:
【题目】X、Y、W、Q 四种元素在元素周期表中的位置如下,下列叙述错误的是
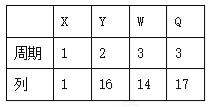
A. Y 的氢化物沸点高于 Q 的氢化物沸点
B. 最高正价与最低负价之和为 0 的元素只有 W
C. 原子半径顺序为:r(W) > r(Q) > r(Y) > r(X)
D. X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 金属钠与水反应:Na +2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
B. 用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-![]() H2O+BaSO4↓
H2O+BaSO4↓
C. 氯化铝溶液中加入过量的氨水:Al3++ 4NH3·H2O ![]() AlO2- + 4NH4++ 2H2O
AlO2- + 4NH4++ 2H2O
D. 在澄清石灰水中通入过量的CO2:OH-+CO2![]() HCO3-
HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(![]() ) = c(Na+)
) = c(Na+)
B. NH3·H2O的电离方程式:NH3H2O ===![]() + OH-
+ OH-
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。

(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+![]() Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
(2)“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作_____剂,具____性。
(3)已知下列反应在一定条件下发生:

在以上的反应中,Fe2+实际上起着 ______________的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )

A. 乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B. 达到平衡时,丙中A的浓度是甲中的2倍
C. 丙中反应的平衡常数大于甲中反应的平衡常数
D. 达平衡时,甲、乙两容器中C物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作不能达到相应目的的是( )
|
|
|
|
A.干燥Cl2 | B.分离汽油与食盐溶液 | C.实验室制取少量蒸馏水 | D.比较Na2CO3与NaHCO3的稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com