
【题目】某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究. Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/molL﹣1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
(1)由上述资料2可得出的正确结论是(选填下列字母编号) a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15molL﹣1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16molL﹣1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为 .
(3)Ⅱ.产物性质探究 Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3 , Cu(OH)2 , 或者CuCO3与Cu(OH)2的混合物.
1)若沉淀是Cu(OH)2 , 生成沉淀的离子方程式是 .
2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1 , K3 , 关闭K2 , K4 , 通入足量空气
c.关闭K1 , K3 , 打开K2 , K4 , 充分反应
d.反应结束后,关闭K2 , 打开K1 , 再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为 , 若不进行步骤d,则会使测得Cu(OH)2的质量分数为(填“偏高”“无影响”“偏低”)
【答案】
(1)abd
(2)CuS+4H2SO4=CuSO4+4SO2↑+4H2O
(3)Cu2++2HCO3﹣=Cu (OH)2↓+2CO2↑;排尽装置中空气中的CO2使测定结果准确;38%;偏低
【解析】解:Ⅰ、(1)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;a.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故A符合; b.图表数据分析可知硫酸浓度选择适当,可避免最后产物中出现黑色物质,故B符合;c.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15molL﹣1 , 故C不符合;d.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故d符合;所以答案是:abd;(2)CuS消失是和浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:CuS+4H2SO4=CuSO4+4SO2↑+4H2O,所以答案是:CuS+4H2SO4=CuSO4+4SO2↑+4H2O;(3)Ⅱ、(1)沉淀为氢氧化铜的判断依据是碳酸氢钠和硫酸铜在水溶液中发生双水解生成,反应的离子方程式为Cu2++2HCO3﹣=Cu (OH)2↓+2CO2↑,所以答案是:Cu2++2HCO3﹣=Cu (OH)2↓+2CO2↑;(2)①空气中含有二氧化碳,空气通过氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气,打开K1、K3 , 关闭K2、K4 , 排除装置中的含二氧化碳气体的空气,避免测定误差的产生;所以答案是:排尽装置中空气中的CO2使测定结果准确;②若沉淀样品的质量为100g,若沉淀样品为CuCO3和Cu(OH)2的混合物,依据生成的二氧化碳物质的量计算减少碳酸铜质量,根据样品质量计算得到氢氧化铜的质量分数= ![]() ×100%=38%,若不进行步骤C,生成的二氧化碳气体中含有水蒸气,被装置D吸收后称量得到二氧化碳质量增大,计算得到碳酸铜质量增大,氢氧化铜的质量减小,则会使测得结果质量分数偏低,
×100%=38%,若不进行步骤C,生成的二氧化碳气体中含有水蒸气,被装置D吸收后称量得到二氧化碳质量增大,计算得到碳酸铜质量增大,氢氧化铜的质量减小,则会使测得结果质量分数偏低,
所以答案是:38%;偏低.


科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是( )
A.δFe晶体中与每个铁原子等距离且最近的铁原子有8个
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δFe晶胞边长为acm,αFe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
A.N4分子属于一种新型的化合物
B.N4分子中只含有非极性键
C.1 mol N4分子所含共价键数为4NA
D.N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A. 同系物B. 同分异构体C. 同位素D. 同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 第ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B. 除短周期外,其他周期均有18种元素
C. 短周期中,同周期元素的离子半径从左到右逐渐减小
D. 主族是由短周期元素和长周期元素共同组成的族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中的离子,因氧化还原反应而不能大量共存的是 ( )
A.Na+、HCO3-、K+、OH-B.Fe3+、SCN-、NH4+、Cl-
C.Fe2+、H+、SO42-、NO3-D.AlO2-、OH-、Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去). 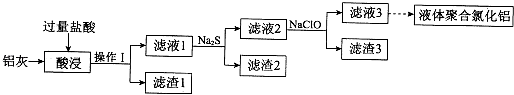
已知某些硫化物的性质如下表:
物质 | 性质 |
Fe2S3 Al2S3 | 在水溶液中不存在 |
FeS | 黑色,难溶于水,可溶于盐酸 |
CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作I是 . Al2O3与盐酸反应的离子方程式是 .
(2)滤渣2为黑色,该黑色物质的化学式是 .
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极). 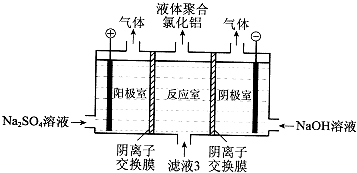
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热电厂用碱式硫酸铝[Al2(SO4)3Al2O3]吸收烟气中低浓度的二氧化硫.具体过程如下:
(1)碱式硫酸铝溶液的制备 往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝(络合物,易溶于水),同时析出生石膏沉淀[CaSO42H2O],反应的化学方程式为 .
(2)SO2的吸收与解吸.吸收液中碱式硫酸铝活性组分Al2O3对SO2具有强大亲和力,化学反应为:Al2(SO4)3Al2O3(aq)+3SO2(g)Al2(SO4)3Al2(SO3)3(aq)△H<0.工业流程如图1所示: 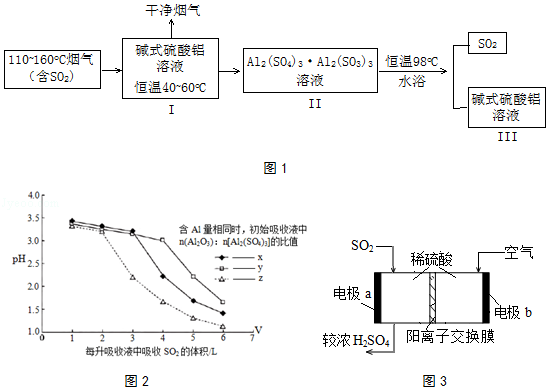
①高温烟气可使脱硫液温度升高,不利于SO2的吸收.生产中常控制脱硫液在恒温40~60oC,试分析原因 .
②研究发现,I中含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合.其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定不同参数的吸收液的pH变化,结果如2图所示:
据此判断初始阶段,SO2的结合方式是 . 比较x、y、z的大小顺序 .
③III中得到再生的碱式硫酸铝溶液,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降,请用化学方程式加以解释: .
(3)解吸得到较纯的SO2 , 可用于原电池法生产硫酸如图3. ①电极b周围溶液pH(填“变大”、“变小”或“不变”)
②电极a的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com