
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、金属钾投入到硫酸铜溶液中:2K+Cu2+=2K++Cu |
| D、铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C 原子基态时最外层电子数是其内层电子总数的2倍 |
| ④ | D 原子核外占有9个轨道,且只有1个未成对电子 |
| ⑤ | E、X、Y三种元素处于第4周期;E元素的正三价离子的3d亚层为半充满,X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;Y元素原子的4p轨道上有3个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
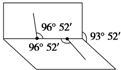 已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.
已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.查看答案和解析>>
科目:高中化学 来源: 题型:
. |
. |

查看答案和解析>>
科目:高中化学 来源: 题型:
A、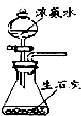 可制取氨气 |
B、 可分离CH3CH2OH和CH3COOC2H5混合液 |
C、 可制备Fe(OH)2并容易观察到白色沉淀 |
D、 可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com