
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
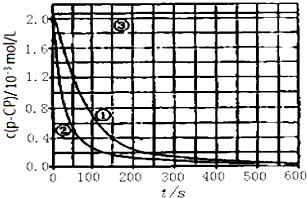
分析 (1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)根据反应速率公式v=$\frac{△c}{△t}$计算平均反应速率;
(3)过氧化氢在高温时易分解;
(4)根据反应速率公式v=$\frac{△c}{△t}$判断;
(5)H2O2和Fe2+的离子反应式为:H2O2+2H++2Fe2+=2H2O+2Fe3+.
解答 解:(1)对比实验的基本思想是控制变量法,温度相同时,变化浓度,在浓度相等时,变化温度,数据分别为:313;3;6.0;0.30;探究pH对降解速率的影响;故答案为:
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究pH对降解速率的影响 | 298 | 10 | 6.0 | 0.30 |
点评 本题考查化学反应速率的影响因素,注意设计对比实验时,只能改变一个条件,否则无法确定影响因素,难度较大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用排饱和食盐水法收集Cl2 Cl2+H2O?H++Cl-+HClO | |
| B. | 纯碱溶液加热使溶液碱性增强CO32-+2H2O?H2CO3+2OH- | |
| C. | 向Mg(OH)2悬浊液中加入FeCl3溶液,悬浊液颜色改变3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+ | |
| D. | 配制FeCl3溶液时,为防止溶液浑浊,常将FeCl3固体溶解于浓盐酸,再加水稀释Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R在化合物中显+1价 | |
| B. | 最高价氧化物对应水化物的碱性:X>R | |
| C. | 原子半径X>Y>Z | |
| D. | 简单气态氢化物的热稳定性:Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| C. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
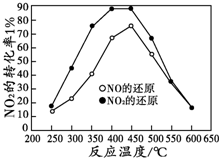 汽车排气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.
汽车排气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③白磷 ④氯气
③白磷 ④氯气 ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷
⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷 ,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.
,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com