
对于常温下PH=10的氨水,下列说法正确的是
A.该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1
B.该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同
C.降低温度,溶液的c(NH4+)/ c(NH3·H3O)减小,PH降低
D.往该溶液中加入足量的NH4Cl固体后,c(NH4+) + c(NH3·H3O)= c(Cl-)
科目:高中化学 来源:2014-2015湖北宜昌市高二3月月考化学试卷(解析版) 题型:填空题
(12分)按要求回答下列问题:
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是 (填字母)
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中不变
D.溶液中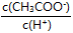 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2= (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是 (填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①写出向NaClO溶液中通入少量CO2的离子方程式 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是 (填字母)
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= (填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:填空题
(10分)金属镁是六方最密堆积,金属铜是面心立方最密堆积,下图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
| (1)镁原子在二维空间的配位数为 |
(2)位于晶胞中部的鎂原子与离它最近两平面 (填“相离”或“相切”或”相交”) | |
(3)请用含R1、NA的数学式子表达金属镁的密度: g/cm3(根号带在分子上) | |
| (4)铜原子在三维空间的配位数为 |
(5)晶胞中面心上的六个铜原子构成的空间几何体名称为 | |
(6)请用含R2、NA的数学式子表达金属铜的密度: g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列关于杂化轨道的叙述中,不正确的是
A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
C.杂化前后的轨道数不变,但轨道的形状发生了改变
D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:推断题
(16分)已知:乙酸酐﹝(CH3CO)2O)﹞常用作有机合成原料。
反应①
反应②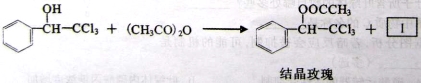
(1)结晶玫瑰是具有强烈玫瑰香气的香料,其分子式为_____________。1mol肉桂酸最多能与_______mol H2发生加成反应。
(2)上述反应①、②中的产物Ⅰ能与碳酸氢钠反应并放出气体,则Ⅰ的结构简式是___________
(3)溴苯与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,反应的化学方程式为________________________________________________(不要求标出反应条件)
(4)结晶玫瑰也可以由下列反应路线合成(部分反应条件略去):
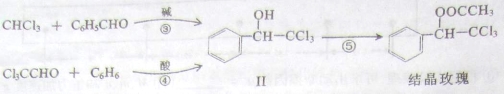
反应③的反应类型是_______________。反应⑤的反应条件为__________________________。
Ⅱ的同分异构体Ⅲ遇FeCl3溶液显色,Ⅲ与足量饱和溴水混合未见白色沉淀产生,Ⅲ与NaOH的乙醇溶液共热发生消去反应,则Ⅲ的结构简式为__________________________(只写一种)
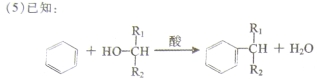
据此推断经反应④得到一种副产物,其核磁共振氢谱有________种峰。(2分)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:填空题
选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)已知YZ2+ 与XQ2互为等电子体,则l mol YZ2+ 中含有π键数目为 。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是 。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为 ,YZ3—的空间构型是 。
(5)E原子的价层电子排布式为 ;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。

①该晶体的化学式为 ,Z的阴离子的配位数为 。
②Z的阴离子的堆积模型为 。
A.简单立方 B.六方最密 C.面心立方
③已知晶胞边长为apm,则晶胞的密度为 g cm—3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
CH4和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)  3C(s)+4NH3(g)
3C(s)+4NH3(g)  H>0,700 ℃时,
H>0,700 ℃时,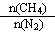 与CH4的平衡转化率的关系如图所示。下列判断正确的是
与CH4的平衡转化率的关系如图所示。下列判断正确的是
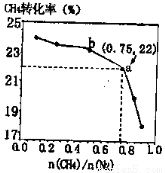
A.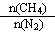 越大,CH4的转化率越高
越大,CH4的转化率越高
B.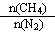 不变时,升温,NH3的体积分数会减小
不变时,升温,NH3的体积分数会减小
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:填空题
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
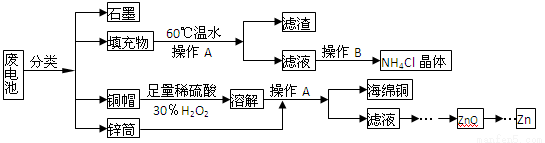
(1)填充物用60 ℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:选择题
下列实验操作能达到预期实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管, 加入几滴0.1 mol/L KMnO4溶液 |
B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com