
| A. | ②③⑤ | B. | ①③⑤ | C. | ④⑤ | D. | ②⑤ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 甲烷和乙醇均能发生取代反应 | |
| B. | 蛋白质、淀粉、油脂均能发生水解反应 | |
| C. | 溴乙烷与NaOH水溶液共热生成乙烯 | |
| D. | 油脂和淀粉都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
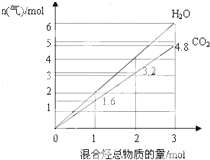 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 可能有乙烯 | B. | 一定有甲烷 | C. | 可能有丙烷 | D. | 一定没有丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com