
【题目】下列物质不能由单质直接化合得到的是( )
A.NO B.Cu2S C.FeCl3 D.FeCl2
科目:高中化学 来源: 题型:
【题目】(每空1分)Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
(1)下列有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,写出苯与溴发生反应的化学方程式 ___________________________________,
预测该芳香烃____________ (填“能”或“不能”)发生该类反应。
A.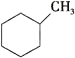 B.
B. C.
C.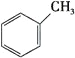
(2)下列有机物属于羧酸类的是_________ (填字母)。
a.CH3CHO b.![]() c.
c. 
(3)下列有机物属于糖类的是_________ (填字母)。
A.油脂 B.纤维素 C.蛋白质
Ⅱ.下列几组物质中,互为同位素的有____________,互为同素异形体的有___________,互为同系物的有____________,互为同分异构体的有____________,属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]() ④
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚烂多彩的物质世界都是由各种元素组成的。请在氧、碳、氢、钠这4种元素中选择适当的元素,按要求用化学用语填空(每空只要求写一个):(1)最轻的气体是 ;(2)因与人体血红蛋白结合而使人中毒的物质 ;(3)白酒、啤酒、红酒等酒精类饮料中的主要溶质 ;(4)实验室制备氧气的反应原理(用化学方程式表示) 。
(5)农村的情洁能源沼气燃烧的化学方程式 ;
(6)生成物能使澄清石灰水变浑浊的化合反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.4mol Cl-、0.1mol Al3+及一定量的SO42-,则其中所含SO42-的物质的量为
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.45mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等且组成完全相同的镁-铝合金,一份投入足量的稀硫酸中,生成氢气的体积是7.84L;另一份投入足量的氢氧化钠溶液,生成氢气的体积是3.36L(以上体积数据均在标准状况下测得)。计算这种镁-铝合金中镁的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D代表原子序数依次增大的四种短周期非金属元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13; ②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。
试根据以上叙述回答:
(1)B单质的结构式为________,画出C元素的原子结构示意图________________;
(2)下列环境问题与B与C形成的化合物有关的是________;
A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
II.现有下列短周期元素相关性质的数据:
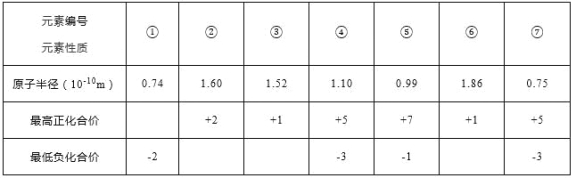
试回答下列问题:
(l)元素⑤在周期表中韵位置__________________;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是_____________(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原予均达到8电子稳定结构的化合物是___________(写化学式);
(4)以下叙述正确的是____________。
A.氢化物的沸点为④<⑦
B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快
D.最高价氧化物对应水化物的碱性③>⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
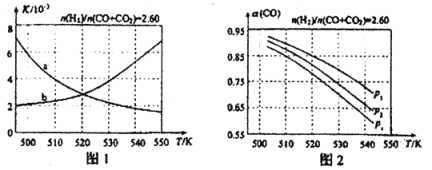
(4)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com