
【题目】化合物A是基本有机化工原料,由A合成高分子化合物C和![]() 的合成路线如下图(部分反应条件略去):
的合成路线如下图(部分反应条件略去):

已知:①R-CN![]() R-COOH
R-COOH
②![]()
回答下列问题:
(1)A的化学名称是____________。
(2)C分子中所含官能团的名称是____________;D的结构简式是____________。
(3)B![]() C和G
C和G![]() H的反应类型分别是____________、____________。
H的反应类型分别是____________、____________。
(4)A![]() E的化学方程式是_________________________________________。
E的化学方程式是_________________________________________。
(5)F![]() G的化学方程式是_________________________________________。
G的化学方程式是_________________________________________。
(6)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种(不含立体异构);其中某种同分异构体M与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1,则M的结构简式是______________________________。
【答案】丙烯 酯基 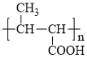 加聚反应 取代反应 CH2=CHCH3+Cl2
加聚反应 取代反应 CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl CH2=CHCH2OH+
CH2=CHCH2Cl+HCl CH2=CHCH2OH+![]()
![]()
![]() 8
8 ![]() 、
、![]()
【解析】
A为C3H6,A发生加成反应生成的B为CH3CH=CHCOOCH3,则A结构简式为CH2=CHCH3,B发生加聚反应生成的C为聚丁烯酸甲酯,其结构简式为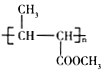 ,聚丁烯酸甲酯发生碱性水解反应然后酸化得到聚合物D,D的结构简式为
,聚丁烯酸甲酯发生碱性水解反应然后酸化得到聚合物D,D的结构简式为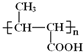 ;A与Cl2在光照条件下发生反应生成E,D发生水解反应生成F,F和C4H5Cl发生信息②的加成反应生成G,则F分子结构中含有一个碳碳双键,C4H5Cl分子结构中含有两个碳碳双键,结合F分子式C3H6O可知,F结构简式为CH2=CHCH2OH、E结构简式为CH2=CHCH2Cl,X为2-氯-1,3-丁二烯(
;A与Cl2在光照条件下发生反应生成E,D发生水解反应生成F,F和C4H5Cl发生信息②的加成反应生成G,则F分子结构中含有一个碳碳双键,C4H5Cl分子结构中含有两个碳碳双键,结合F分子式C3H6O可知,F结构简式为CH2=CHCH2OH、E结构简式为CH2=CHCH2Cl,X为2-氯-1,3-丁二烯(![]() ),F和X发生加成反应生成G,G与NaCN发生取代反应生成H,H在酸性条件下水解生成
),F和X发生加成反应生成G,G与NaCN发生取代反应生成H,H在酸性条件下水解生成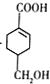 ,由此推出H为
,由此推出H为![]() ,G为
,G为![]() ,由此分析解题。
,由此分析解题。
(1)A的结构简式为CH2=CHCH3,其化学名称是丙烯;
(2)C的结构简式为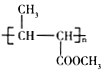 ,分子中含有的官能团的名称是酯基;D的结构简式是
,分子中含有的官能团的名称是酯基;D的结构简式是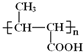 ;
;
(3)B为CH3CH=CHCOOCH3,发生加聚反应生成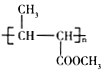 ;G为
;G为![]() ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成![]() ;
;
(4)A为CH2=CHCH3,在光照条件下与氯气发生取代反应生成CH2![]() CH2=CHCH2Cl+HCl;
CH2=CHCH2Cl+HCl;
(5)F为CH2=CHCH2OH,其和2-氯-1,3-丁二烯(![]() )发生加成反应生成
)发生加成反应生成![]() 的化学方程式是CH2=CHCH2OH+
的化学方程式是CH2=CHCH2OH+![]()
![]()
![]() ;
;
(6)B为CH3CH=CHCOOCH3,其分子式为C5H8O2,分子结构中含有酯基,则它的同分异构体中,与B具有相同的官能团且能发生银镜反应,说明含有HCOO-,烃其分子式为C4H7O—,其中结构C=C-C-C中连接HCOO-有4种、C-C=C-C中连接HCOO-有2种,C=C(C)2中连接HCOO-有2种,即满足条件的B的同分异构体共有8种;其中![]() 和
和![]() 与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1。
与H2加成的产物(C5H10O2)的核磁共振氢谱有4组峰,且峰面积比为6∶2∶1∶1。


科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是___。
(2)反应①的化学方程式为___。
(3)反应③的离子方程式为___。
(4)反应⑧的化学方程式为___。
(5)反应⑥过程中的现象是____。
(6)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的元素符号:
A_____,C_____,D_____,E__________
(2)用电子式表示B、F形成的化合物_____。
(3)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为_____, C、F两种元素最高价氧化物的水化物之间反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
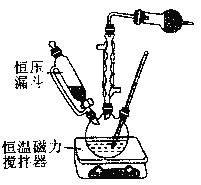
【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
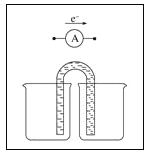
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。
(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个烧杯中均盛有足量的氯化铜溶液。请按要求回答下列问题:
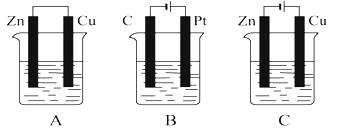
(1)![]() 、
、![]() 、
、![]() 三个装置中不属于电解池的是______。
三个装置中不属于电解池的是______。
(2)![]() 池中
池中![]() 是______极,
是______极,![]() 池中
池中![]() 移向______极(填“
移向______极(填“![]() ”或“
”或“![]() ”)。
”)。
(3)![]() 池中
池中![]() 电极上发生反应__________(填“氧化”或“还原”)
电极上发生反应__________(填“氧化”或“还原”)
(4)![]() 池中
池中![]() 电极上的电极反应为______,反应过程中
电极上的电极反应为______,反应过程中![]() ______(填“变大”“变小”或“不变”)
______(填“变大”“变小”或“不变”)
(5)![]() 池中总反应的化学方程式为______
池中总反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备叔丁基苯(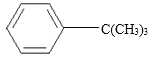 )的反应和有关数据如下:
)的反应和有关数据如下:
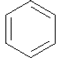 +ClC(CH3)3
+ClC(CH3)3
 +HCl
+HCl
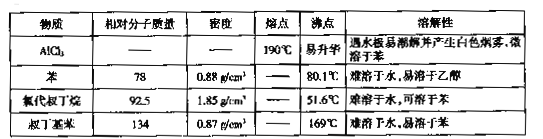
I.如图是实验室制备无水AlCl3,可能需要的装置:
(1)检查B装置气密性的方法是_______。
(2)制备无水AlCl3的装置依次合理的连接顺序为__________(埴小写字母),其中E装置的作用是________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
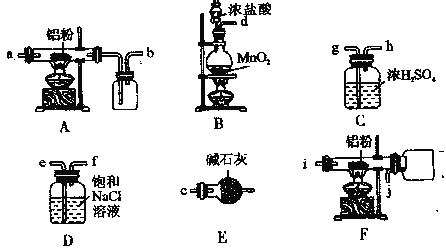
Ⅱ.如图是实验室制备叔丁基苯的装置(夹持装置略):
在三颈烧瓶中加入50 mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(4)使用恒压漏斗的优点是_______;加入无水MgSO4固体的作用是________。
(5)洗涤混合物时所用的试剂有如下三种,正确的顺序是________。(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是 ( )
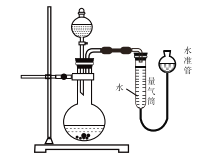
A. 测定一定质量的![]() 和
和![]() 混合物中
混合物中![]() 的含量
的含量
B. 确定分子式为![]() 的有机物分子中含活泼氢原子的个数
的有机物分子中含活泼氢原子的个数
C. 测定一定质量的![]() 晶体中结晶水数目
晶体中结晶水数目
D. 比较Fe3+和Cu2+对一定质量的双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
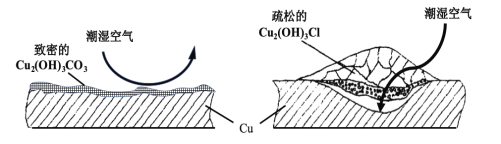
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
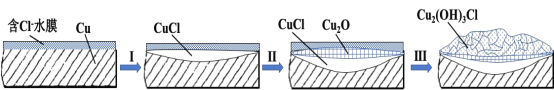
① 过程Ⅰ的正极反应物是___________。
② 过程Ⅰ负极的电极反应式是_____________。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
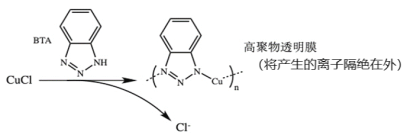
请回答下列问题:
①写出碳酸钠法的离子方程式___________________。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com