
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )

A.Y的最高化合价为+6
B.离子半径:W>Q>Y>X
C.氢化物的沸点:Y>Q
D.最高价氧化物的水化物的酸性:W>Q
C
【解析】
试题分析:由题意知:X是N;Y是O;W是S;Q是Cl.。A.O原子的最外层有6个电子,由于其原子半径较小,在参加反应时容易获得电子,因此其最高化合价不可能为+6 。错误。B.对于电子层结构相同的微粒,核电荷数越大,离子半径就越小。对于电子层结构不同的微粒,电子层数越多,离子半径就越大。因此离子半径:W>Q>X>Y。错误。C.在水分子间存在氢键,而在HCl的分子间只有分子间作用力,所以沸点H2O>HCl。正确。D.非金属性Cl>S,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此酸性HClO4>H2SO4,错误。
考点:考查元素周期表、元素周期律的知识。


科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.S2—、Al3+、ClO-、Cl- B.K+、Mg2+、OH-、NO3-
C.H+、Mg2+、SiO32-、SO42- D.NH4+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:填空题
香料Ⅴ的制备方法如下:

(1)化合物I的分子式为 ,Ⅳ中含氧官能团的名称是 。
(2)化合物I可由 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为 。
(4)该工艺中第①步的目的是 。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入 ,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为 。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列各组离子,在碱性条件下能大量共存,在强酸性条件下发生氧化还原反应的是
A.Mg2+、Na+、SO42-、HCO3— B.Na+、K+、NO3—、SO32—
C.K+、Na+、SiO32—、ClO— D.NH4+、Na+、SO42—、NO3—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:推断题
化合物Ⅳ为一种重要化工中间体,其合成方法如下:

(1)化合物Ⅱ的分子式为_______________;反应②的反应类型为________________。
化合物IV中含有的官能团是 。(写名称)
(2)化合物I在NaOH醇溶液中加热反应,生成两种有机化合物(互为同分异构体),请写出任意一种有机化合物的结构简式:______________
(3)1mol化合物III与足量NaOH反应消耗NaOH的物质的量为 mol。
(4)化合物IV在浓硫酸催化下反应生成六元环状酯类化合物,写出该反应的化学方程式 ________________。
(5)根据题给化合物转化关系及相关条件,请你推出 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为 、 ,它们物质的量之比是 。
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为 、 ,它们物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:填空题
碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为 。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
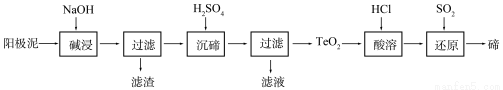
①“碱浸”时TeO2发生反应的化学方程式为 。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是 ;防止局部酸度过大的操作方法是 。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Cl2与过量的镁铁反应,转移2nA个电子
B.常温下,16g CH4含有8nA个电子
C.1L 0.5 mol·L-1Na2SO4溶液中含有nA个SO42-
D.常温常压下,22.4LCO2含有nA个CO2分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
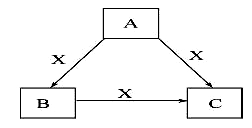
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.阿司匹林是解热镇痛药,长期大量食用会有水杨酸反应,应停药并静脉注射NaHCO3溶液
B.食用一定量的油脂能促进人体对某些维生素的吸收
C.正常情况下,人体血液的pH总保持弱酸性范围,人体具有自动缓冲系统,能使血液的pH达到生理平衡
D.雾霾会引起呼吸道疾病
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com