
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:问答题
(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 ;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8 ℃,熔点-116 ℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下图Ⅰ: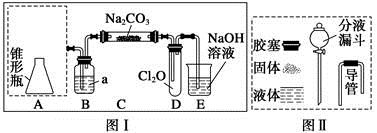
回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。
(2)B中试剂a应选用 (填字母序号)。
a.CCl4 b.饱和NaCl溶液
c.浓H2SO4 d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为 Cl2+ Na2CO3+ = NaHCO3+ NaCl+ Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
| 实验步骤 | 现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 | |
| 步骤二:向a试管中滴加BaCl2溶液,静置。 | 无明显现象,证明固体中不含Na2CO3。 |
| 步骤三: | |
| 步骤四: | 则证明固体中含有NaCl。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
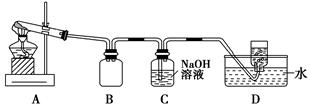
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。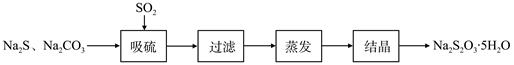
(1)吸硫装置如图所示。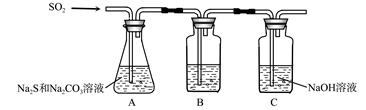
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得
高纯硅。以下是实验室制备四氯化硅的装置示意图。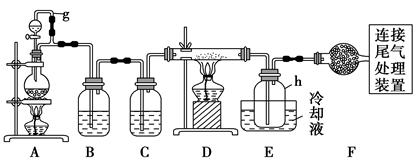
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。
①生石灰应该装在 (填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因: 。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二: 。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 | |
| 2 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。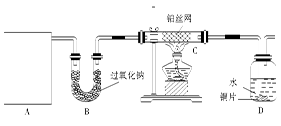
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是 (填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为 (选填下列仪器编号,固定装置省略)。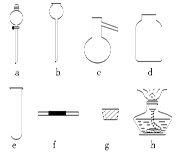
(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
① ;
② 。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是 ;
②写出C中发生反应的化学方程式: ;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入________,振荡 | | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com