

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
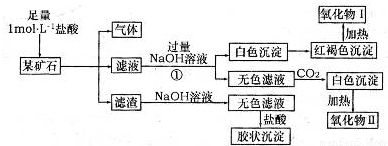
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
查看答案和解析>>
科目:高中化学 来源:2014届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:实验题
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图:
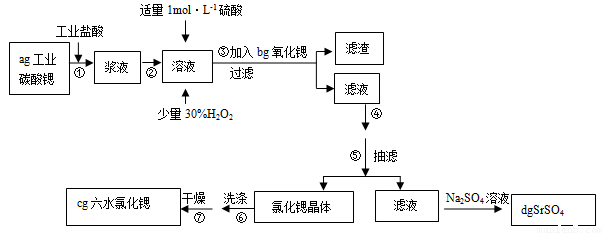
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
A.水 B.硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
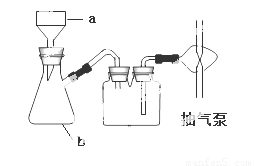
(4)指出下图中仪器b 的名称 , 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是 ,抽气使滤纸紧贴在漏斗瓷板上;
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省肇庆市高三第二次高考模拟理综化学试卷(解析版) 题型:计算题
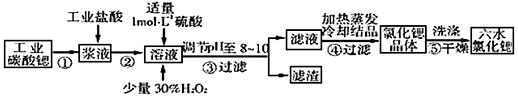
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
|
|
SrSO4 |
BaSO4 |
Sr(OH)2 |
|
Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com