
����Ŀ����ѧ���о�������ͼװ�ö���Ȼ�������������ɻ���̬ת��������̬�����ٶԻ�������Ⱦ����֪�ס��ҳ��з����ķ�Ӧ��ͼ��ʾ������˵����ȷ���ǣ� ��
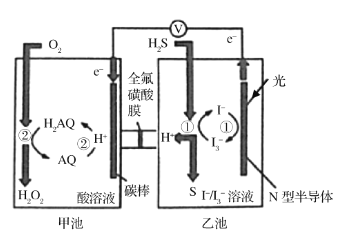
A.ȫ������ĤΪ�����ӽ���Ĥ��H+�Ӽ׳������ҳأ��ҳ���Һ��pH��С
B.��·��ÿת��2mol���ӣ��׳���Һ��������32g
C.N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪH2S+I3-=3I-+S��+2H+
D.�׳���̼���Ϸ����ĵ缫��ӦΪAQ+2H++2e-=H2AQ
���𰸡�D
��������
�׳��У�����������Ӧ��H2AQ+O2= H2O2+AQ��AQ+2H++2e-=H2AQ��H2AQ�Ǵ������ܷ�ӦΪ2H++O2+2e-=H2O2��OԪ�ػ��ϼ���0�����ߵ�1�ۣ�̼���������������ϵĵ缫��ӦΪAQ+2H++2e-=H2AQ���ҳ��У�N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪ3I--2e-= I3-���ҳص��ܷ�ӦΪH2S-2e-=2H++S����
A��ȫ������ĤΪ�����ӽ���Ĥ����ͼ��֪��H+���ҳ�����׳أ��ҳ���Ȼ������H+����������׳�Ǩ�ƣ�����ת�Ƶ���Ŀ��H+����Ŀ��ͬ�����ҳص�pH���䣬��A����
B��H+���ҳ�����׳أ��׳ص��ܷ�ӦΪ2H++O2+2e-=H2O2����·��ÿת��2mol���ӣ���Һ���ӵ���1mol���������������ҳ�ת��2mol H+��������2mol�����ӵ�����m=nM=2mol��1g/mol=2g�����Լ׳���Һ��������32g+2g=34g����B����
C��N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪ3I--2e-= I3-���ҳص��ܷ�ӦΪH2S-2e-=2H++S������C����
D�����ݷ�����֪���׳���̼���Ϸ����ĵ缫��ӦΪAQ+2H++2e-=H2AQ����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ�ָ�Ч���ݼ�����ϳ�·������ͼ��ͼ��
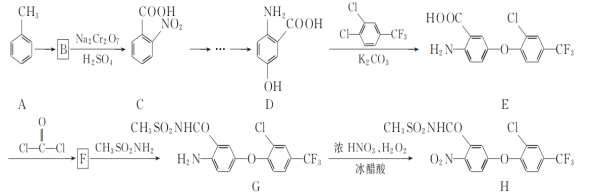
��1��E�к�������������Ϊ____��____��
��2��A��B�ķ�Ӧ����Ϊ____��
��3��д��ͬʱ��������������D��һ��ͬ���칹��Ľṹ��ʽ��____��
�ٲ��ܷ���ˮ�ⷴӦ������FeCl3��Һ������ɫ��Ӧ��
�ڷ�������4�ֲ�ͬ��ѧ�������⡣
��4��F�ķ���ʽΪC15H7ClF3NO4������Ԫ�ӻ�����д��F�Ľṹ��ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����֪ʶ��Ȩ������ú���Ҵ���ҵ����Ŀ���������̣�����ú�Ƶ�����������ٽ��������ת��Ϊ�Ҵ����������ת��Ϊ�Ҵ��漰��Ӧԭ����
����Ӧ��CH3COOCH3(g)��2H2(g)![]() C2H5OH(g)��CH3OH(g) ��H1=-23.61kJmol-1
C2H5OH(g)��CH3OH(g) ��H1=-23.61kJmol-1
����Ӧ��CH3COOCH3(g)��C2H5OH(g)![]() CH3COOC2H5(g)��CH3OH(g) ��H2=0.99kJmol-1
CH3COOC2H5(g)��CH3OH(g) ��H2=0.99kJmol-1
�ڴ��������µķ�Ӧ����Ϊ��*��ʾ����̬��
��ѧ������H2��2H*
���淴Ӧ��CH3COOCH3+4H*��CH3CH2OH*+CH3OH*
��ѧ�Ѹ���CH3CH2OH*��CH3CH2OHCH3OH*��CH3OH
��֪����ѧ�����Ļ�ܴ�������Ӧ�ķ�Ӧ���ʡ�
��1��2CH3COOCH3(g)��2H2(g)![]() CH3COOC2H5(g)��2CH3OH(g) ��H3����H3=___��
CH3COOC2H5(g)��2CH3OH(g) ��H3����H3=___��
��2���������������������C2H5OHƽ����ʵ���___��
A.���� B.���� C.��ѹ D.��ѹ E.����
��3����1L�ܱ������г���1mol������������������ƽ��ת�������¶Ⱥ�������(x)[x=![]() ]�Ĺ�ϵ��ͼ1��
]�Ĺ�ϵ��ͼ1��
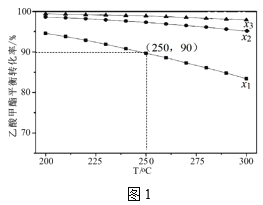
��x1��x2��x3�Ĵ�С��ϵΪ___��
��250�桢x1=10��C2H5OH��ѡ����Ϊ60%��������Ӧ��ƽ�ⳣ��Ϊ___(����2λ��Ч���֣��������Ҵ�ѡ����=![]() ��
��
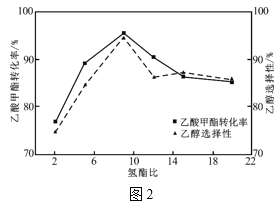
��4������������ͬ����Ӧ������ͬʱ�䣬���������ת�������Ҵ���ѡ�����������ȵĹ�ϵ��ͼ2��ʾ��������(x)��2~9֮�䣬�Ҵ���ѡ�����������ԭ��Ϊ___��
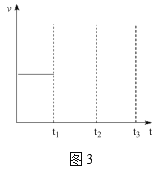
��5��������������Ӧ���ں�ѹ�����£��������������������2molһ��ʱ����ƽ�⣬����t1ʱ���ٳ����1mol�ķ�Ӧ������������䣩��t2ʱ���´ﵽƽ�⣬����ͼ3�л���t1~t3�����淴Ӧ���ʱ仯��ʾ��ͼ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ����ѡ���װ�û��������г�װ������ȥ�����ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A.����ͼװ���Ʊ����ռ���������
B.����ͼװ��̽��SO2�������Ժ�Ư����
C.����ͼװ���ռ�����������β������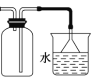
D.����ͼװ�ôӱ����屽�Ļ����Һ�з�����屽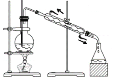
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4)��ˮ�еij����ܽ�ƽ���������¡�����˵����ȷ���ǣ� ��
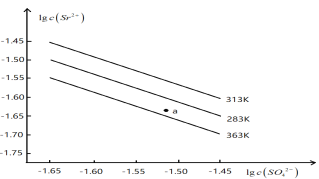
A. �¶�һ��ʱ�� Ksp(SrSO4)��c(SO42��)���������С
B. ������ͬ�¶��У�313 KʱKsp(SrSO4)���
C. 363 Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ
D. 283K�µ�SrSO4������Һ���µ�363K���Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��һ���������壬����������滷���������Ӱ�죬ά�ִ�����CO2��ƽ�����̬��������������Ҫ���塣
��1��CO2����ϳɵ�̼ϩ����������Ч����CO2���Ժϳ�C2H4Ϊ������ת����Ϊ�������У�
��һ����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H1=+41.3kJ/mol
CO(g)+H2O(g) ��H1=+41.3kJ/mol
�ڶ�����2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ��H2=-210.5kJ/mol
C2H4(g)+2H2O(g) ��H2=-210.5kJ/mol
CO2����ϳ���ϩ���Ȼ�ѧ����ʽΪ__��
��2������CO2��H2�ϳɼ״�����һ����Ч����CO2��;������Ӧ���£�CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H3
CH3OH(g)+H2O(g) ��H3
�����ݻ�Ϊ2L�ĺ����ܱ������У�ͨ��2molCO2��3molH2����������Ӧ������˵���ܹ������ÿ��淴Ӧ�ﵽƽ��״̬����__������ĸ��
a.����1.5molH2ʱ����0.5molCH3OH����
b.ת��3mol����ʱ������11.2L����״���£�CO2
c.��ϵ��������ܶȲ���
d.ˮ����������������ֲ���
e.��λʱ��������H2������H2O�����ʵ���֮��Ϊ3��1
���о��¶ȶԸ÷�Ӧ�״����ʵ�Ӱ�졣��210�桫290�棬����ԭ������CO2��H2��Ͷ�ϱȲ��䣬��һ�����ٷ���������Ӧ���õ��״�ƽ��������¶ȵĹ�ϵ��ͼ��ʾ����H3__0�����������=�����������ж�������__��
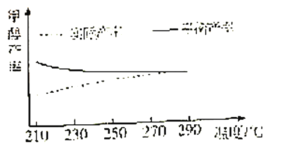
����һ�̶��ݻ����ܱ������з���������Ӧ����Ҫ���ƽ��ʱCH3OH���ʣ�����Բ�ȡ�Ĵ�ʩ��__������ĸ����
a.���� b.������� c.����CO2��Ũ�� d.����H2��ѹ e.����������� f.������״�
��3����һ���¶Ⱥʹ��������£�Ҳ�ɽ�CO2ת��Ϊȼ��CH4����Ӧ����ʽΪCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)����30��ʱ��һ������CO2��H2����������ݻ�Ϊ1L�ĺ����ܱ������з���������Ӧ��5min��ﵽ��⣬��ʱ�����ʵ�Ũ�����±���
CH4(g)+2H2O(g)����30��ʱ��һ������CO2��H2����������ݻ�Ϊ1L�ĺ����ܱ������з���������Ӧ��5min��ﵽ��⣬��ʱ�����ʵ�Ũ�����±���
���� | CO2(g) | H2(g) | CH4(g) | H2O(g) |
Ũ��/mol��L-1 | 0.2 | 0. | a | 1.6 |
��a=__���÷�Ӧƽ�ⳣ��K=__��
��4����TiO2/Cu2Al2O4Ϊ����������CH4���Խ�CO2ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ��ʾ�����������������Ҫȡ�����¶�Ӱ��ķ�Χ��__��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����__��
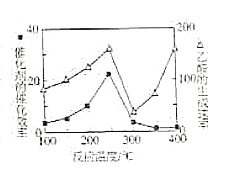
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������(FexO)1.52 g�������������У���������Һ��ͨ���״����112 mL Cl2��ǡ�ý�Fe2+��ȫ����������˵����ȷ����(����)
A. FexO�������������ֻ������FeCl3��H2O
B. ��״����112 mL Cl2�����ʵ�����5 mol
C. x=0.8
D. ͨ��Cl2������Ӧ�����ӷ���ʽ��Fe2++Cl2![]() Fe3++2Cl��
Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���������ͼ���ʼ�ת����ϵ�����ʼ�ķ�Ӧ��Ϊһ��ת������ѡ����

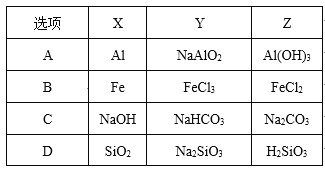
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵���������
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50��
B.����ѹǿʹƽ��������Z�ķ����ƶ�
C.��25���£���Ӧ��ƽ�ⳣ��Ϊ1600���ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
D.��25���£����c(X)=0.04mol��L-1��c(Y)=0.1mol��L-1��c(Z)=0.08mol��L-1�����ʱv��<v��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com