
【题目】已知A、B、C三种分子所含原子的数目依次为1、3、6,且分子中均含有18个电子,B、C是由两种元素组成的,且分子中两种元素原子的个数比均为1:2。请回答下列问题。
(1)A的分子式是__________,写出A原子的价电子排布式:__________
(2)B分子的中心原子的杂化类型是__________,分子的空间构型是__________,该分子属于__________(填“极性”或“非极性”)分子。
(3)C的化学式是__________,分子中含有的化学键类型是____________________。
科目:高中化学 来源: 题型:
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
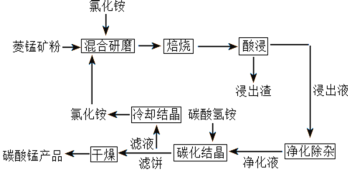
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
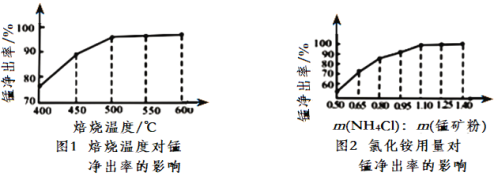
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
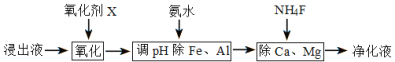
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)又称碳酰氯,下列关于光气的叙述中正确的是
A.COCl2中含有2个σ键和1个π键
B.COCl2中C原子杂化轨道类型为sp2
C.COCl2为含极性键和非极性键的极性分子
D.COCl2分子的空间构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,100 mL 1.0 mol/L Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反应。下列说法正确的是( )
A.Na2C2O4溶液中C2O42-数目为0.1N A
B.稀硫酸中水电离的c(H+)=0.1 mol/L
C.KMnO4溶液浓度为0.1 mol/L
D.反应过程中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 都是非极性分子,
都是非极性分子,![]() 都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
A.所有原子在同一平面上B.分子中每个键的键长应相等
C.A的相对原子质量小于BD.在ABn中A原子没有孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+![]() Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+![]() Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________。
④生成CuCl的离子方程式是____________________。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________。
编号 | 实验 | 现象 |
III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )

p2和195 ℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃时,0~3 min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2时,在B点:v正>v逆
D.在p2和195 ℃时,该反应的平衡常数为25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
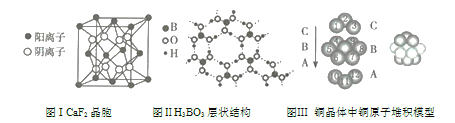
(1)图I所示的CaF2晶胞中与Ca2+最近且等距离的F-的个数为____________。
(2)图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____________,H2BO3晶体中硼原子个数与极性键个数之比为____________。
(3)由图Ⅲ所示的铜原子的堆积模型可知,未标号的铜原子形成晶体后其周围最紧邻的铜原子数为____________。
(4)三种晶体中熔点最低的是其晶体受热熔化时,克服的微粒之间的相互作用为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,4,6-三硝基甲苯是一种淡黄色的烈性炸药,可由甲苯与浓硝酸和浓硫酸的混合物在加热条件下制取。其结构简式如图所示,下列有关说法不正确的是( )

A.2,4,6-三硝基甲苯的化学式为![]()
B.2,4,6-三硝基甲苯中氮元素的质量分数为18.5%
C.甲苯与浓硝酸和浓硫酸的混合物发生取代发应只可能有2,4,6-三硝基甲苯生成
D.2,4,6-三硝基甲苯的核磁共振氢谱中只有两组峰,且峰面积之比为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com