
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
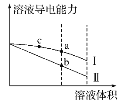
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
【答案】D
【解析】
稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,加水稀释时,醋酸进一步电离,所以稀释过程中,醋酸导电能力大于盐酸,则Ⅰ为醋酸稀释曲线,Ⅱ为盐酸稀释曲线。
A.稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,故A错误;
B.导电能力越大,说明离子浓度越大,酸性越强,则a、b、c三点溶液的pH大小顺序为c<a<b,故B错误;
C.相同温度下,Kw相同,a点的Kw等于b点的Kw值,故C错误;
D.a点离子浓度小于c点离子浓度,氢离子浓度越大,对水的电离抑制程度越大,则a点水电离的H+物质的量浓度大于c点水电离的H+物质的量浓度,故D正确。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
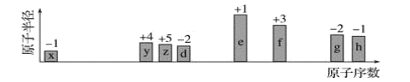
根据判断出的元素回答问题:
(1)f在周期表中的位置是________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________________。
(4)e的单质在足量![]() 中燃烧的化学方程式:_________________________。
中燃烧的化学方程式:_________________________。
(5)上述元素可组成盐![]() 。向盛有
。向盛有![]() 溶液的烧杯中滴加
溶液的烧杯中滴加![]() 溶液,沉淀物质的量随
溶液,沉淀物质的量随![]() 溶液体积的变化示意图如下:
溶液体积的变化示意图如下:
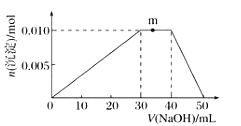
①R溶液的电离方程式____________________________。
②写出m点反应的离子方程式:____________________。
③若在R溶液中改加![]() 溶液,充分反应后,溶液中产生沉淀的物质的量为________
溶液,充分反应后,溶液中产生沉淀的物质的量为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生反应X2+2Y22Z (X、Y、Z都为气体)。已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.4 mol·L-1
B.Y2为0.5 mol·L-1
C.X2为0.2 mol·L-1
D.Z为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
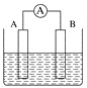
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮是重要的氧化剂,存在如下平衡: 2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)已知:2NO2(g)![]() N2O4(g) △H=﹣57.20kJ·mol﹣1。一定条件下,在体积一定的密闭容器中反应2NO2(g)
N2O4(g) △H=﹣57.20kJ·mol﹣1。一定条件下,在体积一定的密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_________(填字母)。
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是_________(填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L﹣1、c(N2O4)=0.0120mol·L﹣1,反应2NO2(g)![]() N2O4(g)的平衡常数K=__________。
N2O4(g)的平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气中的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)已知氮及其化合物发生如下反应:
N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
N2(g)+2O2(g)![]() 2NO2(g) ΔH=+68kJ·mol-1
2NO2(g) ΔH=+68kJ·mol-1
则2NO(g)+O2(g)![]() 2NO2(g)ΔH___kJ·mol-1。
2NO2(g)ΔH___kJ·mol-1。
(2)利用KMnO4脱除二氧化硫的离子方程式为:___
①□MnO![]() +□SO2+□H2O
+□SO2+□H2O![]() □MnO
□MnO![]() +□ +□ 。(在“□”里填入系数,在“__”上填入微粒符号)
+□ +□ 。(在“□”里填入系数,在“__”上填入微粒符号)
②在上述反应中加入CaCO3可以提高SO2去除率,原因是___。
(3)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I.CaSO3(s)+SO![]() (aq)
(aq)![]() CaSO4(s)+SO
CaSO4(s)+SO![]() (aq)
(aq)
II.SO![]() (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)![]() SO
SO![]() (aq)+2NO
(aq)+2NO![]() (aq)+2H+(aq)
(aq)+2H+(aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图所示。

a点后NO2去除率降低的原因是___。
(4)检测烟道气中NOx含量的步骤如下:
I.将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO![]() ;
;
II.加水稀释至100.00mL,量取20.00mL该溶液,与V1mLc1mol·L-1FeSO4标准溶液(过量)充分混合;
III.用c2mol·L-1KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2mL。
①NO被H2O2氧化为NO![]() 的离子方程式为___。
的离子方程式为___。
②滴定过程中主要使用的玻璃仪器有___和锥形瓶等。
③滴定过程中发生下列反应:
3Fe2++NO+4H+=NO↑+3Fe3++2H2O
MnO![]() +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
烟气气样中NOx折合成NO2的含量为__mg·m-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮能形成多种氧化物、氢化物。
(1)已知:①![]()
②![]()
则![]() 与
与![]() 反应生成两种无毒气体的热化学方程式为_____________。
反应生成两种无毒气体的热化学方程式为_____________。
(2)使用高效催化剂可大大减少汽车尾气排放出的![]() 含量,某研究所的科研人员探究了
含量,某研究所的科研人员探究了![]() 时等质量的三种催化剂对
时等质量的三种催化剂对![]() 还原
还原![]() 的催化效果(其他条件相同),所得结果如图所示:
的催化效果(其他条件相同),所得结果如图所示:
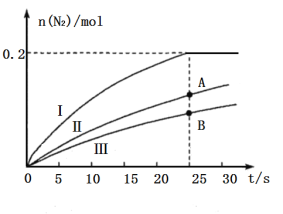
①如果不考虑催化剂价格,则使用催化剂______(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B两状态下,生成![]() 的速率大小关系是___________。
的速率大小关系是___________。
②若容器容积为2L,开始时加入![]() 、
、![]() ,在催化剂Ⅰ的作用下达到如图所示平衡,则反应
,在催化剂Ⅰ的作用下达到如图所示平衡,则反应![]() 在该温度下的平衡常数
在该温度下的平衡常数![]() ______
______![]() 。
。
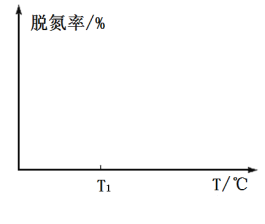
③在如图坐标系中画出使用催化剂Ⅰ(其他条件相同)时,25s时容器内反应的脱氮率(![]() 转化率)与温度的关系图___________。
转化率)与温度的关系图___________。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:![]() ,其速率方程式为
,其速率方程式为![]() (k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。
①已知反应![]() ,在温度低于
,在温度低于![]() 时是由两个基元反应构成的复杂反应,该反应的速率方程式为
时是由两个基元反应构成的复杂反应,该反应的速率方程式为![]() ,则其两个基元反应分别为:Ⅰ.______
,则其两个基元反应分别为:Ⅰ.______![]() ______;Ⅱ.略,这两个反应中活化能较小的是__________。
______;Ⅱ.略,这两个反应中活化能较小的是__________。
②某科研小组测得![]() 时该反应的
时该反应的![]() 、
、![]() 生成
生成![]() 的速率
的速率![]() 的关系如下:
的关系如下:
| 0.025 | 0.05 | 0.025 |
| 0.04 | 0.04 | 0.12 |
|
|
|
|
则该温度下的反应速率常数![]() ______
______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧发电副产物可用于提取高纯度氧化铝,其工艺流程如下:
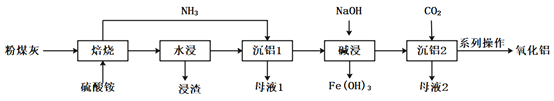
已知:粉煤灰的主要成份是Al2O3,主要杂质是SiO2、Fe2O3。
“焙烧”的主要反应:Fe2O3+4(NH4)2SO4=2NH4Fe(SO4)2+6NH3↑+3H2O Al2O3+4(NH4)2SO4=2NH4Al(SO4)2+6NH3↑+3H2O 回答下列问题:
(1)“浸渣”的主要成分为________(填化学式)。
(2)“沉铝1”中生成含铝元素沉淀的离子方程式是________。
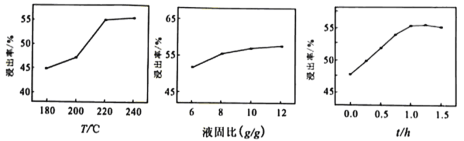
(3)结合下图分析“碱浸”时最优条件是________(填序号)。
A、200℃、8g/g、1.0h B、200℃、10g/g、1.5h C、220℃、10g/g、1.0h D、220℃、12g/g、1.5h
(4) “沉铝2”发生反应的离子方程式为________。
(5)流程中“一系列操作”是________。
(6)流程中可循环利用的物质是________。(填化学式)
(7)用1t含铝10.8%的粉煤灰,制得高纯度Al2O3 80kg,其产率为________%(结果保留1位小数)。
(8)传统工艺流程中第一步是将粉煤灰用硫酸“酸浸”脱硅,与之相比硫酸铵法的优点是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com