
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | 再向试管中加入少量固体 | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | |||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | |
分析 (1)本题的实验原理是酸性高锰酸钾氧化双氧水,酸性高锰酸钾褪色生成二价锰离子,双氧水被氧化成氧气;
(2)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(3)根据反应速率表达式计算出反应速率;
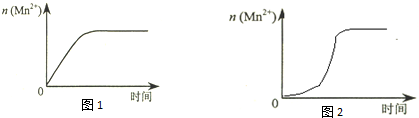
(4)①由图乙可知反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸镁在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
解答 解:(1)高锰酸钾在酸性环境下能够氧化过氧化氢,生成氧气,高锰酸根离子被还原为二价锰离子,反应中化合价降低的元素是锰元素,从+7价降到+2价,过氧化氢中氧元素化合价从-1价升高到0价,要使得失电子守恒,高锰酸根离子系数为2双氧水系数为5,依据原子个数守恒反应的离子方程式:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,
故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,
故答案为:②和③; ①和②;
(3)混合后溶液中高锰酸钾的浓度为:$\frac{0.01mol/L×4.0mL}{(2.0+4.0)mL}$=$\frac{0.01×4.0}{6.0}$mol/L,40s即$\frac{2}{3}$min,反应完全时平均反应速率v(KMnO4)=$\frac{△c}{△t}$=$\frac{0.01×4.0}{6.0}$$÷\frac{2}{3}$mol/(L•min)=0.01mol/(L•min),
故答案为:0.01;
(4)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,故答案为:
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | 再向试管中加入少量固体 | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | MnSO4 | ||
| ④ | ||||||
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度不大,注意掌握温度、催化剂对化学反应速率的影响,解题关键是对比分析图表中的数据找出相同点和不同点,然后得出合理结论.


科目:高中化学 来源: 题型:选择题
| A. | 8,18,32,32 | B. | 8,18,18,32 | C. | 8,18,18,18 | D. | 8,8,18,18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨和金刚石不能相互转化 | |
| B. | 金刚石比石墨稳定 | |
| C. | 破坏1mol金刚石中的共价键消耗的能量比石墨多 | |
| D. | 1 mol石墨比1 mol金刚石的总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>P>O>F | B. | 稳定性:PH3<NH3<H2O<HF | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③ | C. | ②③④ | D. | 只有④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(溴) | 苯 | 萃取分液 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | 乙醇(H2O) | 生石灰 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
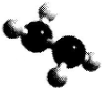 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧| A. | 标准状况下,11.2LN2中含电子总数为5 NA | |
| B. | 标准状况下,22.4LN2 H4 中所含原子总数为6 NA | |
| C. | 标准状况下,3.2gN 2H4 中含有共价键的总数为0.6 NA | |
| D. | 若生成3.6gH2 O,则上述反应转移电子的数目为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com