
| A. | 石灰石溶于盐酸:CaCO3+2 H+→Ca2++H2O+CO2↑ | |
| B. | 氯水滴加到碘化钾溶液中:Cl2+I-→I2+Cl- | |
| C. | 铁和硫酸铜溶液反应:Fe+Cu2+→Fe2++Cu | |
| D. | 醋酸溶液和氢氧化钾溶液混合:CH3COOH+OH-→CH3COO-+H2O |
分析 A.二者反应生成氯化钙和二氧化碳、水;
B.原子个数不守恒;
C.二者反应生成二价铁离子和铜离子;
D.二者反应生成醋酸钾和水.
解答 解:A.石灰石溶于盐酸,离子方程式:CaCO3+2 H+→Ca2++H2O+CO2↑,故A正确;
B.氯水滴加到碘化钾溶液中,离子方程式:Cl2+2I-→I2+2Cl-,故B错误;
C.铁和硫酸铜溶液反应,离子方程式:Fe+Cu2+→Fe2++Cu,故C正确;
D.醋酸溶液和氢氧化钾溶液混合,离子方程式:CH3COOH+OH-→CH3COO-+H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实遵循原子个数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 在反应2 H2S+SO2→3 S+2 H2O中被氧化与被还原的硫原子的质量 | |
| B. | 相同温度下,0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 CH3COOH溶液中的c(H+) | |
| C. | 在密闭容器中,N2+3H2?2NH3达平衡时的c(NH3)与c(N2) | |
| D. | Na2CO3晶体中Na+与CO32-离子个数比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W 的最高价氧化物的水化物酸性比Z的强 | |
| B. | 原子半径:Z>W,离子半径:Z<W | |
| C. | Y的气态氢化物可与W的气态氢化物反应生成一种离子化合物 | |
| D. | X元素形成的化合物种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的化学式为:KAl(SO4)2 | |
| B. | 氯离子的结构示意图为: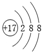 | |
| C. | 纯碱的化学式:NaCO3 | |
| D. | 氨水的电离方程式:NH3•H2O→NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
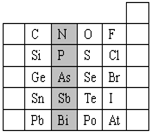 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 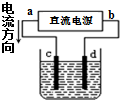 若采用图示装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| B. | 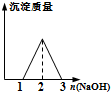 向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 | |
| C. |  达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| D. | 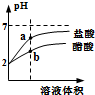 将pH=2的盐酸和醋酸分别加水稀释,a点溶液中水的电离程度比b点溶液中水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
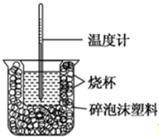
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com