
| A. | 为加快过滤速度,可用玻璃棒在过滤器中搅拌 | |
| B. | 胶体、溶液、浊液分属不同类别的本质是其透过滤纸的性质不同 | |
| C. | 分液漏斗和容量瓶使用前都需要检查是否漏液 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
分析 A.过滤实验中玻璃棒的作用是引流,目的是防止滤液弄破滤纸,使实验失败;
B.胶体、溶液、浊液分属不同类别的本质是分散质微粒大小不同;
C.分液漏斗和容量瓶均带有瓶塞;
D.量筒不能用于配置溶液.
解答 解:A.过滤实验中玻璃棒的作用是引流,目的是防止滤液弄破滤纸,使实验失败.用玻璃棒搅动漏斗里的液体,容易把滤纸弄破,起不到过滤的作,故A错误;
B.分散系的根本区别在于分散质微粒直径的大小,小于100nm为溶液,大于100nm为浊液,在1nm~100nm的为胶体,故B错误;
C.分液漏斗和容量瓶均带有瓶塞,使用前都需要检查是否漏液,故C正确;
D.量筒不能用于配置溶液,应改为烧杯中进行,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质分离与提纯、溶液配制等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液中滴加硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 硫酸铜溶液与烧碱溶液反应:Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO32- NO3- | C. | CO32- NO3- | D. | CO32-、NO3- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中铁元素可能以Fe2+形式存在 | |
| B. | 反应后溶液中c(N03-)=0.85 mol/L | |
| C. | 反应后的溶液最多还能溶解1.4 g Fe | |
| D. | 1.12 L气体可能是NO、NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
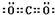 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、CO32-、Na+ | B. | Na+、OH-、SO42- | C. | Cu2+、OH-、H+ | D. | Ba2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是
Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是| A. | 铜做阳极、石墨做阴极,石墨电极上产生氧气 | |
| B. | 铜电极发生的反应为:2Cu-2e-+2OH-=Cu2O+H2O | |
| C. | 在电解过程中OH-向石墨电极移动 | |
| D. | 当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com