
欲测定在干燥空气中已部分氧化的Na2SO3样品中Na2SO3的质量分数,甲、乙两组分别设计并完成实验如下:
甲组:称取ag样品,利用下图(甲)所示装置(B、C之间导管先充满水),测出A中加入足量较浓H2SO4反应后,量筒C中水的体积V mL。
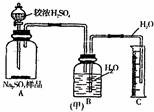
(1)B、C之间导管先充满水的目的 。
(2)你认为本组实验的Na2SO3测定值将偏 (填“高”或“低”),主要原因是 。
(3)简述最简单改进的方法 。
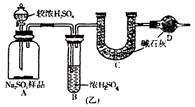
乙组:称取a g样品,利用图(乙)所示装置,测出A中加入足量较浓H2SO4后装置C中足量碱石灰增重为b g。
(1)B装置的作用是 ,
D装置的作用是 。
(2)你认为本组实验的Na2SO3测定值将偏 (高、低),主要原因是
。
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 足量试剂X |
| 足量O2充分灼烧 |
| 密封(容器带自由移动的活塞) |
| ||
| 足量试剂Y |
| 1-V3 |
| 6.72 |
| 1-V3 |
| 6.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测不定期某无水Na2SO3被氧化的程度。
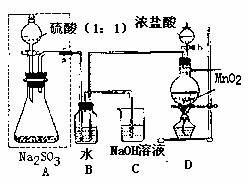
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,是应如何检查虚线框内装置的气密性?
。
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,是述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
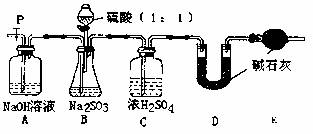
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO4样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将虑液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com