
下列说法正确的是( )
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列溶液中,c(H+)最大的是
A.0.1 mol/L HCl溶液 B.0.1 mol/L NaOH溶液
C.0.1 mol/L H2SO4溶液 D.0.1 mol/L CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:实验题
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10﹣10 | 5.0×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:选择题
德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是( )
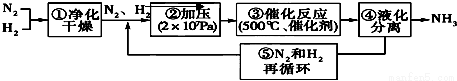
A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 | 实验操作及现象 | 实验目的或结论 |
A | 向1,2两试管中分别加入等浓度H2O2溶液10 mL、1 mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;试管2中产生气体较快 | 证明FeCl3溶液的催化效率更高 |
B | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
C | 测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明盐酸酸性比醋酸强 |
D | 取5 mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色) | 证明: Ksp(AgI) <Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上第三次检测理综化学试卷(解析版) 题型:填空题
大气污染问题日益引起全民关注。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法 不正确的是_________ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~ 2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
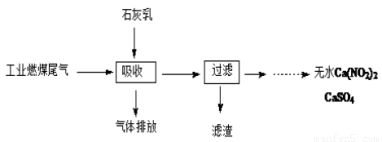
① 硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为________________________ 、_______________ 。
② CaSO4可以调节水泥的硬化时间。尾气中2molSO2被石灰乳逐渐吸收最终生成了1mol CaSO4,该过程中转移的电子数目为_________________________
③ Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式______________________________ 。
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X, 再利用电解法使K2CO3溶液再生,其装置示意图如下: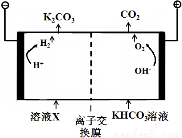
①在阳极区发生的反应包括____________和 H ++ HCO3- = H2O + CO2↑。
②简述CO32-在阴极区再生的原理____________________________ 。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。 已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) =H2O(g) Δ H1= -242 kJ/mol
CH3OH(g) + 3/2 O2(g) =CO2 (g) + 2 H2O(g) Δ H2= -676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式________________________ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、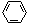 、KI溶液一一区分开的试剂是:
、KI溶液一一区分开的试剂是:
A.FeCl2溶液 B.NaOH溶液 C.水 D.溴水
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3  2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com