
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
分析 (1)①根据化学平衡的标志来判断;
②先根据反应 NH2COONH4(s)?2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
③根据压强对化学平衡移动的影响来回答;
④氨基甲酸铵分解反应是吸热反应;
(2)⑤根据化学反应速率的公式来计算;
⑥由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
解答 解:(1)①A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、该反应是气体体积增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故C正确;
D、因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为$\frac{2}{3}$.故D错误;
故答案为:BC;
②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3 mol/L、1.6×10-3 mol/L,代入平衡常数表达式:K=(3.2×10-3 )2×1.6×10-3 =1.6×10-8,
故答案为:1.6×10-8;
③若在恒温下压缩容器体积,则压强增大,平衡逆向移动,所以固体质量会增加,
故答案为:增加;
④氨基甲酸铵分解反应是吸热反应,反应焓变大于0,△H>0,
故答案为:>;
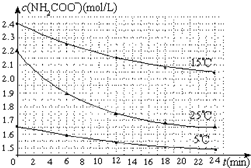
(2)⑤化学反应速率V=$\frac{△c}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
⑥因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题考查了化学平衡状态的判断、平衡常数的计算,反应速率的计算等,注重了基础知识的考查,本题难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
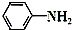 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$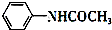 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍在中间 | B. | 偏向左盘 | C. | 偏向右盘 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com