
 (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.分析 (1)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的物质的量为xmol、O2的物质的量为ymol,根据平均相对分子质量确定x、y关系,据此计算解答;
(2)由于氯气能与氢气化合生成了氯化氢,氧气与氢气化合生成了水,设与氯气的气体为X,则氧气的体积为(100mL-x),根据方程式表示出各自消耗氢气的体积,结合消耗氢气总体积列方程计算,相同条件下体积之比等于物质的量之比,根据M=$\frac{m}{n}$计算平均摩尔质量,进而确定平均相对分子质量;
(3)根据质量守恒计算生成C的质量,再根据M=$\frac{m}{n}$计算其摩尔质量;
(4)钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
(5)①根据c=$\frac{1000ρω}{M}$计算;
②先设氯化氢的体积,根据氯化氢的体积计算其质量,再根据质量发生公式计算氯化氢的体积.
解答 解:(1)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,故氧气的质量分数=$\frac{1mol×32g/mol}{1mol×32g/mol+3mol×28g/mol}$×100%=27.6%;
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为:$\frac{1mol×32g/mol+1.5mol×16g/mol}{1mol×32g/mol+3mol×28g/mol}$×100%=48.3%,
故答案为:27.6%;48.3%;
(2)设氯气的气体为x,氧气的体积为(100mL-x),则:
Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl 2H2 +O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
x x 2(100mL-x)(100mL-x)
所以,x+2(100mL-x)=150mL,
解得:x=50mL,氧气的体积为100mL-50mL=50mL,所以,混合气体中Cl2和O2的体积之比为50mL:50mL=1:1.假设氯气和氧气各1摩尔,则混合气体的平均摩尔质量为:$\frac{71g+32g}{2mol}$=51.5g/mol,即平均相对分子质量为51.5,
故答案为:1:1;51.5;
(3)根据质量守恒得C的质量=24gA+40g-32g=32g,M=$\frac{32g}{0.4mol}$=80g/mol,
故答案为:80g/mol;
(4)3L浓度1mol/L的盐酸中HCl的物质的量为3mol,与1mol钠和1mol镁反应时盐酸均过量,钠和镁均完全反应,故生成的氢气的物质的量取决于钠和镁.1mol钠和盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,
氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
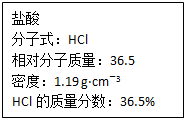
(3))①c=$\frac{1000ρω}{M}$=$\frac{1000×1.19g/mL×36.5%}{36.5g/mol}$=11.9mol/L,
故答案为:11.9;
②设HCl的体积为VL,标况下,氯气的值量=$\frac{V}{22.4}$×36.5g,水的质量=1000mL×1.00g•cm-3=1000g,
其质量分数:$\frac{\frac{V}{22.4}×36.5g}{\frac{V}{22.4}×36.5g+1000g}$×100%=36.5%,
解得:V=353,
故答案为:353.
点评 本题考查了物质的量浓度的计算、混合物反应的计算,题目难度中等,试题知识点较多、计算量较大,充分考查学生的分析、理解能力及化学计算能力,注意掌握物质的量浓度、摩尔质量的概念及计算方法.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生BaSO4和BaSO3沉淀 | B. | 无沉淀产生 | ||
| C. | 产生BaSO4沉淀 | D. | 产生BaSO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
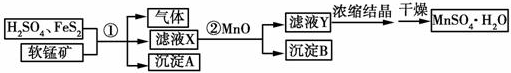
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
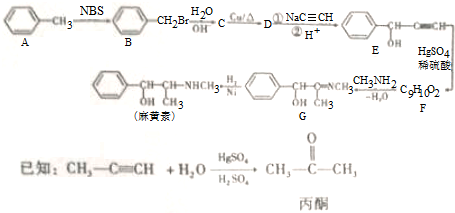

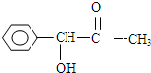 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种) 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.6 mol/L | B. | 2.5 mol/L | C. | 2.3 mol/L | D. | 3.0 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com