
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、SO3+H2O=H2SO4 | ||||
| B、Cl2+H2O=HCl+HClO | ||||
| C、2F2+2H2O=4HF+O2 | ||||
D、C+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
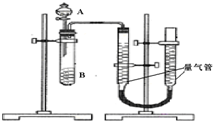 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |

| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体压强不再发生变化 |
| B、混合气体质量不再发生变化 |
| C、反应中CO与H2的物质的量之比为1:1 |
| D、生成nmolCO的同时生成nmolH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
| D、“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式.利用CO2合成聚碳酸酯类可降低塑料的做法符合“低碳经济”的要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:
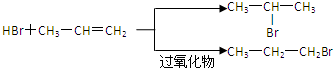
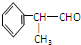 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 2Na+2H2O=2NaOH+H2↑ 3NO2+H20=NO+2HNO3 | 均为水作氧化剂的氧化还原反应 |
| B | SiO2能与NaOH溶液反应也能与氢氟酸反应 Al2O3能与NaOH溶液反应,也能与盐酸反应 | 两种氧化物均为两性氧化物 |
| C | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | Cl2+2FeCl2=2FeCl3 I2+SO2+2H2O=H2SO4+2HI | 均属离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com