
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,溶液稀释过程中所含溶质的物质的量不变,据此计算需要浓硫酸体积,选择合适的量筒;
(3)依据配制一定物质的量浓度溶液的正确操作步骤解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、摇匀等用到的仪器有:量筒、玻璃棒、烧杯、容量瓶、胶头滴管;
故答案为:①③⑤⑥⑦;
(2)质量分数为98%、密度为1.84g•cm-3的浓H2SO4的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设
配制250mL、0.2mol•L-1的稀H2SO4需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得V×18.4mol/L=0.2mol/L×250mL,解得V=2.7mL,所以应选择10mL量筒;
故答案为:2.7;①;
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到 250 mL的容量瓶中,转移时应用 玻璃棒引流.转移完毕,用少量蒸馏水洗涤烧杯 2-3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 1-2cm处.改用 胶头滴管滴加蒸馏水到瓶颈刻度的地方,使溶液的 凹液面最低处与刻度线相切.振荡、摇匀后,装瓶、贴签;
故答案为:250;玻璃棒;2-3;1-2cm;胶头滴管;凹液面最低处与刻度线相切;
(4)①洗涤稀释浓H2SO4后的烧杯,并将洗涤液转移到容量瓶中,操作正确;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液浓度偏高;
③定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度准确,操作正确;
⑤将稀释浓硫酸应将浓硫酸沿着烧杯壁缓缓注入水中,并用玻璃棒不断搅拌,操作错误;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低;
⑦定容时,仰视标线,导致溶液体积偏大,溶液浓度偏低;
所以下列操作中:错误的是:②③⑤⑥⑦,能引起误差偏高的有:②;
故答案为:②③⑤⑥⑦;②;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意容量瓶、量筒规格选择的依据,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
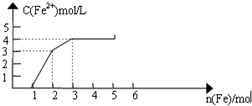 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
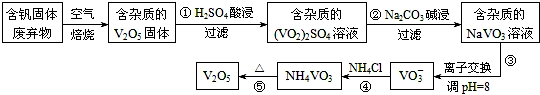
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com