
| A. | 含有-OH的有机化合物性质相同 | |
| B. | 锅炉水垢中的CaSO4可用饱和Na2CO3溶液处理,使之转化为CaCO3后再用盐酸除去 | |
| C. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有单质参加,又有单质生成的反应一定是氧化还原反应 |
分析 A.羟基与苯环直接相连形成的化合物为分类;
B.从难溶电解质的转化的角度分析;
C.根据Na的金属性比K弱,Na和K的沸点大小,制取的适宜温度应能使K蒸汽分离出,而钠为液体;
D.有单质参加又有单质生成的反应不一定是氧化还原反应;
解答 解:A.酚类物质中也含有-OH,但不属于醇,所以性质不同,故A错误;
B.硫酸钙难以除去,可加入碳酸钠转化为碳酸钙,加入盐酸和除去,故B正确;
C.在850℃时使K蒸汽分离出,而钠为液体,可用钠制取钾,而钠的金属性比钾弱,故C错误;
D.有单质参加又有单质生成的反应不一定是氧化还原反应,如同素异形体之间的转化反应,故D错误;
故选B.
点评 本题主要考查了物质的性质,难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据弱酸越稀越电离的规律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
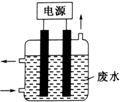 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
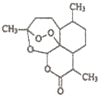 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
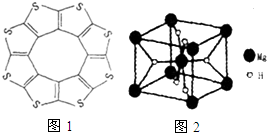 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.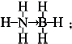 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com