
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备时目前的研究热点。某工艺利用电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2.下列有关描述不合理的是

A.制H2时,产生H2的电极反应式:2H2O+2e-=H2↑+2OH-
B.制O2时,电极3要连接K2
C.若没有电极3,K1和K2直接相连,一样可以得到H2和O2
D.上述过程,若用酸性电解质一样可以实现上述过程
【答案】D
【解析】
A.制取氢气时,阴极上得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,故A正确;
B.制取氧气时,阳极上得电子生成氧气,所以该电极应该连接原电池正极,所以电极3连接K2,故B正确;
C.如果没有电极3,K1和K2直接连接,电极1是阴极、电极2为阳极,阴极上生成氢气、阳极上生成氧气,所以一样可以得到H2和O2,故C正确;
D.①中电极3发生Ni(OH)2-e-+OH-=NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-=Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-,制氧气时补充电极2消耗的OH-,实现NiOOHNi(OH)2的转化,且可循环使用,Ni(OH)2和酸反应,所以酸性条件下不能实现上述目的,故D错误;
故答案为D。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】近日,各地媒体纷纷报道了有“火锅红”、“火锅飘香剂”、“辣椒精”等造就的“化学火锅”的新闻,食品添加剂的使用引起了人们的注意,亟待规范。
乙偶姻是一种应用较广泛的香料.乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1,乙偶姻中含有碳氧双键.与乙偶姻有关的反应如下: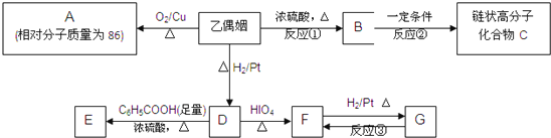
已知:HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO
RCHO+R’CHO
(1)乙偶姻的分子式为__,G的结构简式为__;
(2)反应①、②的反应类型为:①__、②__;
(3)D→E反应的化学方程式为________________;
B→C反应的化学方程式为___________________;
(4)X是乙偶姻的同分异构体,属于酯类,写出2种X可能的结构简式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
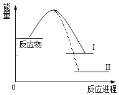
A.1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热
B.N2(g)+3H2(g)![]() 2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
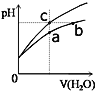
A.a、b、c三点溶液的离子浓度之和a>b>c
B.b点溶液中c(H+)+c(NH3·H2O)= c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc
D.a、b、c三点溶液中水的电离程度 a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
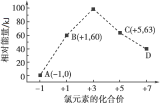
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
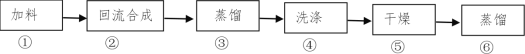
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com