
【题目】除去混合物中的杂质(括号中为杂质),所选试剂和分离方法都正确的是
混合物 | 除杂试剂 | 分离方法 | |
A | 溴苯(溴) | NaOH溶液 | 分液 |
B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
C | 甲苯(苯酚) | 溴水 | 过滤 |
D | 溴乙烷(乙醇) | NaOH溶液 | 分液 |
A. A B. B C. C D. D
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2;
假设2:所得沉淀为_ __;
假设3:所得沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤;
步骤2:甲同学取一定量所得固体,用气密性良好的如图装置(夹持仪器未画出)进行定性实验。

请回答下列问题:
(1)假设2中的沉淀是为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的___ 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__________(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用___________试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有下列离子的溶液中滴加NaCl并通入足量SO2气体后,溶液中还可能大量共存的离子组是( )
A. K+、Fe2+、SO42-- B. Ag+、H+、NO3—
C. NH4+、Fe3+、SO42-- D. Mg2+、Ca2+、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/LNaOH和0.1 mol/LNH4Cl溶液等体积混合后,离子浓度大小的正确顺序是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-) D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种胶体在电泳时,它的粒子向阴极移动。在此胶体中分别加入下列物质:①蔗糖溶液,②硫酸镁溶液,③硅酸胶体,④氢氧化铁胶体,不会发生聚沉现象的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
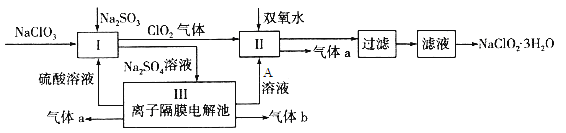
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(PbS)=8×10-28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠。
(1) I中发生反应的离子方程式为 ____________。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是

A. X和Z氢化物的热稳定性和还原性均依次减弱
B. R、W和氢三种元素形成的阴离子有2种以上
C. RY2分子中每个原子的最外层均为8电子结构
D. R、Y、Z的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研宄在其他条件不变时,改变某一条件对A2(g) +3B2 (g) ![]() AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是( )
AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是( )
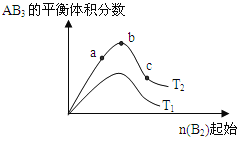
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com