
分析 ①$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010、c(H+).c(OH-)=10-14mol•L-1,则c(H+)=0.01mol/L,溶液的pH=-lg(H+);
②该溶液中c(H+)<c(HA),所以是弱酸,加水稀释促进HA电离,但其电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(A-)、c(HA)都减小,但温度不变水的离子积常数不变;
③A.若溶液M呈中性,则溶液M中c(H+)=c(OH-)=10-7mol•L-1;
B.pH=12的NaOH溶液浓度为0.01mol/L,若V1=V2,酸的物质的量大于NaOH,则酸有剩余,溶液呈酸性;
C.因为NaA溶液呈碱性,要使混合溶液呈酸性,则酸应该过量;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
解答 解:①$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010、c(H+).c(OH-)=10-14mol•L-1,则c(H+)=0.01mol/L,溶液的pH=-lg(H+)=-lg0.01=2,故答案为:2;
②该溶液中c(H+)<c(HA),所以是弱酸,加水稀释促进HA电离,但其电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(A-)、c(HA)都减小,但温度不变水的离子积常数不变,
A.加水稀释促进HA电离,则n(H+)增大、n(HA)减小,溶液体积相同,所以$\frac{c({H}^{+})}{c(HA)}$增大,故错误;
B.加水稀释促进HA电离,n(A-)增大、n(HA)减小,所以$\frac{c(HA)}{c({A}^{-})}$减小,故正确;
C.c(H+)•c(OH-)为离子积常数,温度不变,离子积常数不变,故错误;
D.稀释过程中c(H+)减小,温度不变水的离子积常数不变,所以c (OH-)增大,故错误;
故选B;
③A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,故A正确;
B.若V1=V2,由于酸的浓度大,酸过量,则溶液M的pH一定小于7,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD.
点评 本题考查弱电解质的电离及酸碱混合溶液定性判断,为高频考点,明确弱电解质电离特点是解本题关键,知道②题加水稀释促进HA电离但溶液中c(H+)、c(A-)原理,为易错点.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
1.2mol Cl2与元素A单质完全反应生成0.80mol AClx,则x值为
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某市对大气进行监测,发现首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。将PM2.5样本用蒸馏水处理制成溶液,该溶液中所含水溶性无机离子的浓度如下表:
离子 | K+ | Na+ | NH4+ | H + | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6[ | 2×10-5 | x | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断H+ 的浓度为 mol·L-1
A.1×10-5 mol·L-1 B.3×10-5 mol·L-1
C.6×10-5 mol·L-1 D.1×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
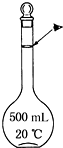 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将下列溶液与1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
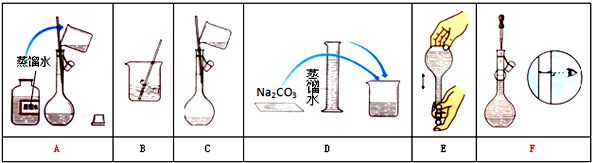
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
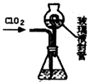 二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下:
二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下: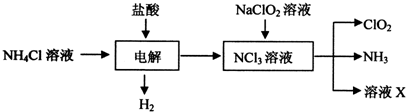
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
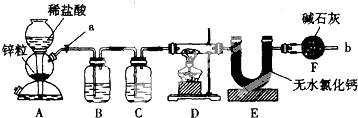
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com