
在酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A.NH 、Al3+、SO
、Al3+、SO 、NO
、NO B.K+、Na+、CO
B.K+、Na+、CO 、NO
、NO
C.K+、NH 、MnO
、MnO 、SO
、SO D.Na+、K+、NO
D.Na+、K+、NO 、HSO
、HSO
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:阅读理解
| 1 | 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸具有以下A~F的性质:A.酸性 B.高沸点难挥发 C.吸水性 D.脱水性 E.强氧化性 F.溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为____________。实验中往往有大量白色固体析出,可见浓硫酸在该实验中表现了哪些性质:____________。(浓硫酸性质用A、B、C、D、E、F填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为__________________________________。硫酸在该反应中表现了哪些性质:____________________________。
(3)在过氧化氢跟稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:____________。与(2)中反应比较反应条件不同的原因是____________。
(4)蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。写出产生有刺激气味气体的化学方程式:____________________________。该实验中浓硫酸表现的性质有____________________。
(5)工业制备CuSO4溶液采用实验(2)的原理而没有采用实验(1)和(3)的原理,是因为(1)和(3)有某些缺点,请你列举(1)和(3)分别有哪此缺点:实验(1)____________________________;实验(3)____________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省高安中学高二上学期期末考试化学试卷(带解析) 题型:实验题
(共16分)
Ⅰ实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下: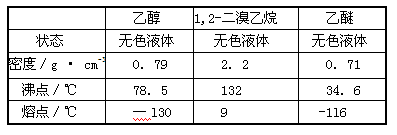
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用 的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 。
Ⅱ.已知烯烃与苯在一定条件下反应生成芳香烃。如:
丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途。
(1)写出丙烯在一定条件下发生聚合反应的化学方程式 。
(2)丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%。A的分子式为 。
(3)丙烯与苯在一定条件下反应可生成D、E、F等多种芳香烃。红外光谱、核磁共振是研究有机物结构的重要方法,根据下列数据,画出D、E的结构。
D:元素组成:C89.94%、H10.06%;1H核磁共振有5个信号。
E:元素组成:C88.82%、H11.18%;1H核磁共振有3个信号。
F:元素组成:C88.82%、H11.18%;1H核磁共振有4个信号。
D: 。 E: 。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高二上学期期末考试化学试卷(解析版) 题型:实验题
(共16分)
Ⅰ实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用 的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 。
Ⅱ.已知烯烃与苯在一定条件下反应生成芳香烃。如:

丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途。
(1)写出丙烯在一定条件下发生聚合反应的化学方程式 。
(2)丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%。A的分子式为 。
(3)丙烯与苯在一定条件下反应可生成D、E、F等多种芳香烃。红外光谱、核磁共振是研究有机物结构的重要方法,根据下列数据,画出D、E的结构。
D:元素组成:C89.94%、H10.06%;1H核磁共振有5个信号。
E:元素组成:C88.82%、H11.18%;1H核磁共振有3个信号。
F:元素组成:C88.82%、H11.18%;1H核磁共振有4个信号。
D: 。 E: 。
查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:实验题


 Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com