
| A. | 千克 | B. | 摩尔/升 | C. | 摩尔 | D. | 千米 |
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
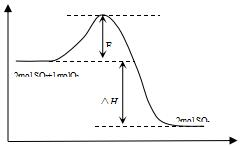 2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.
2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.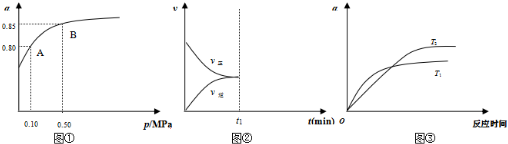
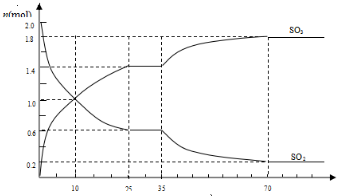
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验含碘盐中的碘元素 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 除去CuSO4溶液中的Fe2(SO4)3,加入足量CuO粉末,充分搅拌过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质可能是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 不能确定该物质中是否含有钾元素 | D. | 该物质一定是金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.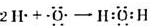 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com