考点:原子核外电子排布,化学键,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)氮是7号元素,价电子数是5,价电子排布图为
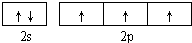
;
(2)氮的最高价氧化物为N
2O
5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
3-,则其阳离子的化学式为:NO
2+,其中心原子价电子对数为
=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,据此答题;
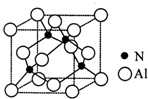
(3)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
×6=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式;
(4)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(5)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,据此答题;
(6)晶体Al原子位于晶胞体顶点和面心,所以晶体中最近的两个Al原子的距离为底面对角线的
,根据晶胞的密度可以求得晶胞边长,进而求得底面对角线的长度,据此可解题.
解答:
解:(1)氮是7号元素,价电子数是5,价电子排布图为

,故答案为:

;
(2)氮的最高价氧化物为N
2O
5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
3-,则其阳离子的化学式为:NO
2+,其中心原子价电子对数为
=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,
故答案为:直线;sp;
(3)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
×6=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式为Al
2O
3+N
2+3C=2AlN+3CO,
故答案为:Al
2O
3+N
2+3C=2AlN+3CO;
(4)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,所以BC正确,
故答案为:BC;
(5)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(6)晶体Al原子位于晶胞体顶点和面心,所以晶体中最近的两个Al原子的距离为底面对角线的
,
根据晶胞的密度ρ=
,可以求得晶胞边长为
cm,
进而求得底面对角线的长度为
×
cm,
所以晶体中最近的两个Al原子的距离为
?cm,
故答案为:
?.
点评:本题考查了原子核外电子排布图、均摊法晶胞的计算、键能与性质的关系、以及晶胞结构的计算等知识,中等难度,其中晶胞的计算是难点.

 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: ;
; ,故答案为:
,故答案为: ;
;

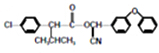 )
)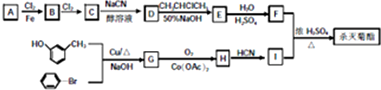
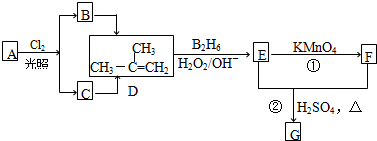
 注:合成路线的书写格式参照如下示例流程图:
注:合成路线的书写格式参照如下示例流程图:
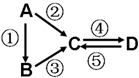 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: