
| A. | 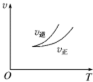 依据图可判断正反应为放热反应 | |
| B. | 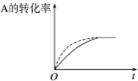 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 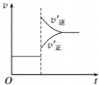 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 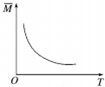 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、变化的条件改变反应速率,缩短反应达到平衡的时间,但是没有改变化学平衡;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,根据反应气体质量和物质的量的情况来判断.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A正确;
B、变化的条件改变反应速率,缩短反应达到平衡的时间,但是没有改变化学平衡,可以是压缩反应装置体积的情况,图象符合改变条件的变化,故B正确;
C、若正反应的△H>0,是吸热反应,升温平衡正向进行,正反应速率大于逆反应速率,图象不符合反应速率的变化,故C错误;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,根据反应知道:反应正向进行气体总质量减小,气体物质的量不变,所以温度升高平衡正向进行,正反应是吸热,逆反应△H<0,故D正确;
故选C.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
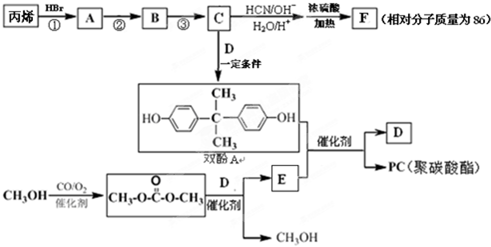

 .
.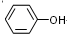 .
. .
.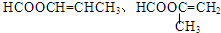 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{ρ}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
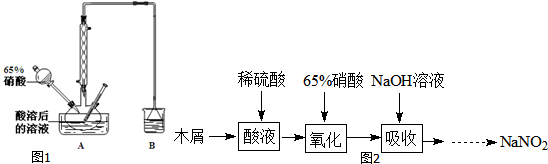
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
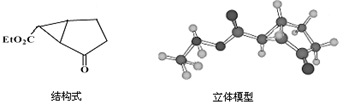
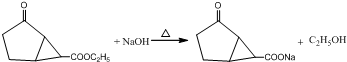 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com