
分析 (1)设达到平衡时,Pb2+的浓度减小x mol•L-1,利用三段表示出平衡浓度,带入Ks计算;
(2)根据Qc与Ks的大小判断反应进行的方向;
(3)根据平衡表达式计算出Pb2+的平衡浓度,反应开始时[Pb2+]等于其平衡浓度加上0.1mol•L-1.
解答 解:(1)设达到平衡时,Pb2+的浓度减小x mol•L-1,则,
Pb2++Sn?Pb+Sn2+
初始浓度 0.1 0
转化浓度 x x
平衡浓度 0.1-x x
Ks=$\frac{x}{0.1-x}$=2.41,解得x=0.07,
因此达到平衡时,Pb2+和Sn2+的浓度各是(0.1-0.07)mol•L-1=0.03mol•L-1、0.07mol•L-1,
答:若初始浓度[Pb2+]=0.1mol•L-1,达到平衡时,Pb2+和Sn2+的浓度各是0.03mol•L-1、0.07mol•L-1.
(2)若[Pb2+]=0.1mol•L-1,[Sn2+]=0.1mol•L-1,Qc=$\frac{0.1}{0.1}$=1<2.41,反应向着正反应方向移动,
答:若[Pb2+]=0.1mol•L-1,[Sn2+]=0.1mol•L-1,反应将向正反应方向进行.
(3)Pb2+的平衡浓度[Pb2+]=$\frac{[S{n}^{2+}]}{K{\;}_{s}}$=$\frac{0.1}{2.41}$mol•L-1=0.04mol•L-1,反应开始时[Pb2+]为0.04mol•L-1+0.1mol•L-1=0.14mol•L-1,
答:若平衡时,[Sn2+]=0.1mol•L-1,反应开始时[Pb2+]是0.14mol•L-1.
点评 本题考查了化学平衡常数的应用,难度中等,会书写平衡常数表达式并能通过据Qc与Ks的大小判断反应进行的方向是解题的关键,三段法是化学平衡常数计算中常用的方法.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
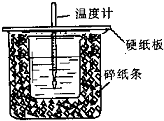 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如右图,回答下列问题:| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
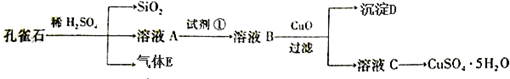
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醛 | 乙酸 | 甘油[X& | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
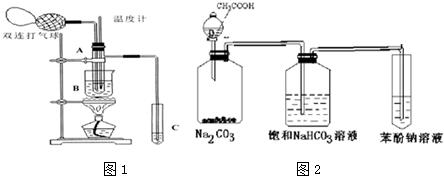
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在恒温恒容 密闭容器中,能说明反应:2N02(g)
密闭容器中,能说明反应:2N02(g) 2NO(g)+02(g)达到平衡
2NO(g)+02(g)达到平衡 状态的是 ( )
状态的是 ( )
①单位时间内生成nmol O2的同时生成2nmol NO2;②单位时间内生成nmol O2的同时生成2nmol N0;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态。
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 | |
| B. | Na在空气中长期放置变成Na2CO3粉末 | |
| C. | 过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K${\;}_{\;}^{35}$ClO3+6H${\;}_{\;}^{37}$Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com