
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2  CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
(1)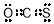 , 极性 (各1分,共2分)
, 极性 (各1分,共2分)
(2)a c (2分)
(3)H2S + 2e → H2↑+S2-(或2H+ + 2e → H2↑)(2分) FeS(1分)
(4)减小,增大(各1分,共2分)
(5)b (2分)
(6)正反应进行程度很大(1分。其他合理答案也给分)
【解析】
试题分析:(1)羰基硫相当于是二氧化碳中的1个氧原子被硫原子取代,所以其电子式为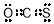 。S和O的非金属性不同,所以该化合物是极性分子。
。S和O的非金属性不同,所以该化合物是极性分子。
(2)a.非金属性越强,最高价氧化物对应水化物的酸性越强,相应的钠盐水解程度越小,所以相同条件下水溶液的pH:Na2CO3>Na2SO4可以碳与硫两元素非金属性相对强弱,a正确;b.非金属性越强,最高价氧化物对应水化物的酸性越强,亚硫酸不是最高价含氧酸,所以酸性:H2SO3>H2CO3不能说明碳与硫两元素非金属性相对强弱,b不正确;c.CS2中碳元素为+4价,硫元素为-2价,说明非金属性是硫强于碳,c正确,答案选ac。
(3)原电池中负极失去电子发生氧化反应,正极得到电子发生还原反应,硫化氢分子中氢元素得到电子,发生还原反应,因此电极反应式为H2S + 2e → H2↑+S2-。负极铁失去电子,生成亚铁离子与硫离子结合生成硫化亚铁,所以负极产物是FeS。
(4)升高温度,会降低羰基硫的转化率,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。则升高温度,平衡常数K减小,而反应速率增大。
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则a.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体密度始终保持不变,不能说明反应达到平衡状态,a不正确;b.由于反应在恒容绝热密闭容器中进行,所以容器内温度保持不变可以说明反应达到平衡状态,b正确;c.平衡时浓度不再发生变化,但物质的浓度之间不一定相等,故c(H2)=c(H2S) 不能说明反应达到平衡状态,c不正确;d.υ(H2)正=υ(H2S)正,但二者的反应速率方向相同,所以不能说明反应达到平衡状态,d不正确,答案选b。
(6)平衡常数越大,反应物的转化率越大,因此若该反应的平衡常数很大,说明正反应进行程度很大。
考点:考查非金属性强弱比较、原电池原理、外界条件对平衡状态以及有关平衡常数的应用


科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
解释下列事实的化学用语正确的是
A.将NH3通入滴有酚酞的水中,溶液变红:NH3 + H2O  NH3·H2O
NH3·H2O 
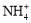 + OH-
+ OH-
B.铜与浓硫酸共热产生气体:Cu+H2SO4(浓) Cu2+ + SO42- + H2↑
Cu2+ + SO42- + H2↑
C.CH3COONa的水溶液呈碱性:CH3COO- + H2O = CH3COOH + OH-
D.用NaOH溶液吸收Cl2:Cl2+2OH- = 2Cl- + H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72- + NO2- + → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列反应所得溶液中,一定只含一种溶质的是
A.向铁粉中加入稀硝酸
B.向烧碱溶液中通入CO2气体
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
苯巴比妥是安眠药的成分,化学式为C12H12N2O3,分子结构中有两个六元环:下图是以A为原料合成苯巴比妥的流程示意图。完成下列填空。
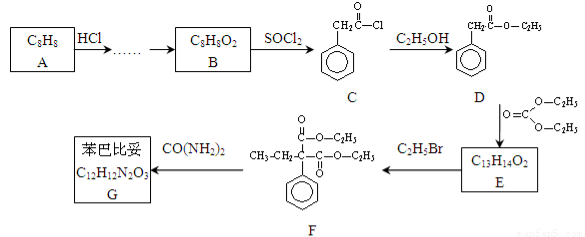
已知:①有机物D、E中亚甲基(—CH2—)的氢原子受羰基影响活性较高,容易发生如下反应:
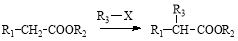
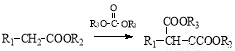
②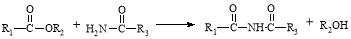
(1)芳香烃A与HCl反应后,制取B还需进行反应的类型依次为 。
(2)一种酯与B互为同分异构体,且苯环上只有一个取代基,该酯同分异构体有 种,写出其中一种结构系统命名 。
(3)写出D 转化为E的化学方程式:
(4)苯巴比妥G的结构简式:
(5)E与CO(NH2)2在一定条件下合成的高分子结构简式:
(6)已知: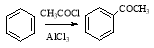 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物 为原料合成
为原料合成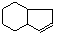 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A B……
B……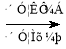 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
某浓H2SO4的标签上写明含H2SO4 96~98.3%,欲得其准确的值,有效的方法是
A.测pH值 B.测导电性大小 C.测密度 D.进行中和滴定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
已知粗碘中含有的IBr和ICl受热都会升华,若先在粗碘中加入下列物质中的一种再加热,就可制得纯净的碘。该物质是
A. KI B.H2O C.Zn D.NaCl
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
由乙炔(C2H2)、苯和甲醛(CH2O)组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为
A.20.7% B.22% C.24.9% D.28%
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+
B.向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C.向Na2S2O3溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D.向苯酚钠溶液中通入少量CO2气体: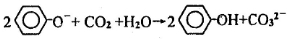
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com