
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
科目:高中化学 来源: 题型:实验题
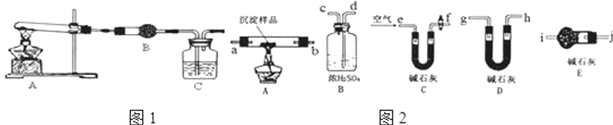
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
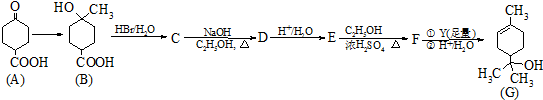
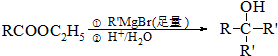
 .
.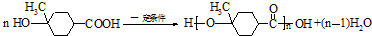 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
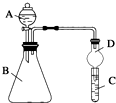 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 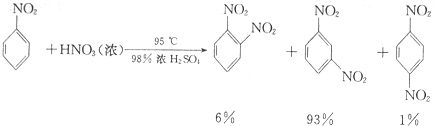
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
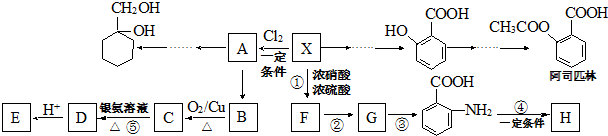
 (苯胺,易被氧化)
(苯胺,易被氧化)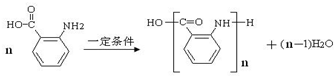 .
.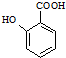 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.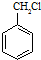 和其他无机物合成
和其他无机物合成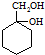 最合理的方案.
最合理的方案.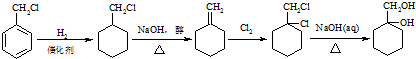 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com