
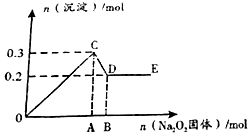
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.分析 过氧化钠与水反应生成氢氧化钠和氧气,反应为2Na2O2+2H2O═4NaOH+O2↑,由图可知,OA段生成白色沉淀发生Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,AB段OH-+Al(OH)3=AlO2-+2H2O,则原溶液中一定含Mg2+、Al3+,一定不含Fe3+、Cu2+、OH-,由电荷守恒可知含阴离子为SO42-,不能确定是否含Na+,以此来解答.
解答 解:由上述分析可知,原溶液中一定含SO42-、Mg2+、Al3+,一定不含Fe3+、Cu2+、OH-,不能确定是否含Na+,
(1)DE段沉淀的化学式为Mg(OH)2,故答案为:Mg(OH)2;
(2)其中的氧化还原反应方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(3)经分析,该溶液中肯定有的离子是SO42-、Mg2+、Al3+,为确定是否含有另外一种离子钠离子,可通过焰色反应得以确定,
故答案为:SO42-、Mg2+、Al3+;焰色反应;
(4)由图可知生成0.1molAl(OH)3,0.2molMg(OH)2,则AB段消耗NaOH为0.1mol,OA段消耗NaOH为0.3mol+0.4mol=0.7mol,由Na原子守恒可知,图中OA段和AB段所消耗Na2O2物质的量之比为7:1,故答案为:7:1;
(5)由电荷上述可知,该溶液中阴离子的物质的量n的取值范围≥$\frac{0.2mol×2+0.1mol×3}{2}$=0.35mol,
故答案为:≥0.35.
点评 本题考查无机物的推断,为高频考点,把握发生的反应、电荷守恒、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素进入人体内会完全水解为葡萄糖从而为人体提供能量 | |
| B. | 含有食品添加剂的食物对人体均有害 | |
| C. | 硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用 | |
| D. | 含氮、磷元素的化合物大量排入江河湖泊中会导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
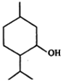
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com