
(8分)描述下列反应的现象并写出反应的离子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,现象______,离子方程式_______________。
(2)向NaHCO3溶液中滴加稀H2SO4,现象_______,离子方程式______________。
(3)稀HNO3和Ba(OH)2溶液混合,现象__ ____,离子方程式_______ ______。
比较:上述三个离子反应发生的条件的不同点是______;相同点是______。
24、每空1分,共8分
(1) 生成红褐色沉淀; Fe3++3OH-===Fe(OH)3↓
(2) 生成无色无味气体; HCO3-+H+===CO2↑+H2O
(3) 观察不到明显现象; H++OH-===H2O
不同:(1)中生成沉淀,(2)中生成气体和H2O,(3)中生成难电离物质H2O
相同:都使溶液中的某种离子浓度发生了明显变化
【解析】
试题分析:根据题中所给信息,结合已经学习过的知识分析,(1) 生成红褐色沉淀:Fe3++3OH-=Fe(OH)3↓(2) 生成无色无味气体: HCO3-+H+===CO2↑+H2O (3) 观察不到明显现象: H++OH-===H2O , 根据实验现象可知看出不同:(1)中生成沉淀,(2)中生成气体和H2O,(3)中生成难电离物质H2O;根据离子反应的实质可知它们的相同点:都使溶液中的某种离子浓度发生了明显变化。
考点:考查物质在溶液中的反应现象和离子方程式的书写。


科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:填空题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
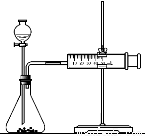
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验可选用的实验药品是 ;
应该测定的实验数据是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
在可逆反应2A+3B  xC+D中,A、B、C、D均为气态。已知:起始浓度A为5mol·L-1、B为3mol·L-1;C的反应速率为0.5mol·L-1·min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol·L-1, 下列关于此反应的说法中,不正确的是
xC+D中,A、B、C、D均为气态。已知:起始浓度A为5mol·L-1、B为3mol·L-1;C的反应速率为0.5mol·L-1·min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol·L-1, 下列关于此反应的说法中,不正确的是
A.平衡浓度A/B=5:3 B. x=2
C. B的平衡浓度为1.5mol·L-1 D.A的转化率为20%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:填空题
(6分)在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B能产生无色气体;B+C能产生白色沉淀;A+D能产生白色沉淀;A+C无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):
A:________,B:________,C________,D________。
(2)A+B反应的离子方程式为___________________________。
(3)A+D反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
CaH2常作生氢剂。对于反应CaH2+2H2O=Ca(OH)2+2H2↑,有如下判断:①H2只是氧化产物; ②H2既是氧化产物,又是还原产物; ③H2O是氧化剂④CaH2是氧化剂;⑤此反应中的氧化产物与还原产物的分子数之比是1∶1,上述判断中正确的是
A.①④⑤ B.②③④ C.③④⑤ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
根据下列化学方程式判断物质氧化性或还原性强弱排序正确的是
① 2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu
A.还原性:Fe > Cu>FeCl2 B.还原性:Fe > FeCl2> Cu
C.氧化性:CuCl2>FeCl3>FeCl2 D.氧化性:FeCl3 >FeCl2>CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:选择题
在密闭容器中反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述不正确的是 ( )
A.平衡向逆反应方向移动 B. a+b>c+d
C.Z的体积分数减小 D. X的转化率下降
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列物质中含有自由移动的Cl-的是
A.KClO3溶液 B.KCl溶液 C.氯气(Cl2) D.NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com