
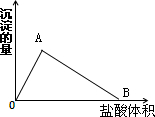
| 0.001mol |
| 0.1mol/L |
| 0.004mol |
| 0.1mol/L |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| 实验序号 | 样品的质量/g | NaOH 溶液的体积/ml | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、23:36 |
| B、46:39 |
| C、115:39 |
| D、23:78 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、③④⑤ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应容器 | 甲 | 乙 | 丙 |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 |
| 与盐酸反应生成气体(L) 与氢氧化钠反应产生气体(L) | 0.560 0.336 | 0.672 x | 0.672 y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原反应物中CuO与Fe2O3物质的量的比为1:1. |
| B、反应后所得CO2的质量为40g |
| C、参加反应的CO的质量为11.2g |
| D、原反应物中CuO与Fe2O3物质的量的比为1:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
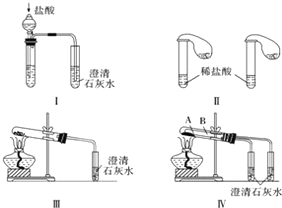
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com