
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
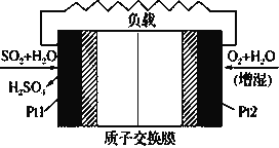
A.该电池放电时H+从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
C.Pt2电极附近发生的反应为: O2+2H2O+4e-=4OH-
D.放电过程中若消耗的22.4L O2(标准状况),Pt1电极区增加4mol H+
【答案】D
【解析】
由图可知,Pt1电极上SO2转化为H2SO4,S元素化合价升高被氧化,为燃料电池的负极,电极反应式为SO2+2H2O-2e-═SO42-+4H+,Pt2电极为燃料电池的正极,O2在正极上得电子被还原生成水,电极反应式为O2+4H++4e-═2H2O,电池的总反应方程式为2SO2+O2+2H2O=2H2SO4。
A项、放电时,阳离子移向正极,Pt1电极为负极,Pt2电极为正极,则该电池放电时氢离子从Pt1电极经过内电路流到Pt2电极,故A错误;
B项、Pt1电极通入SO2,SO2在负极失电子发生氧化反应生成H2SO4,电极反应为SO2+2H2O-2e-═SO42-+4H+,故B错误;
C项、Pt2电极为燃料电池的正极,酸性条件下,O2在正极上得电子被还原生成水,电极反应式为O2+4H++4e-═2H2O,故C错误;
D项、标准状况下22.4L O2的物质的量为1mol,放电过程中若消耗1mol O2,转移电子数目为4mol,由负极反应式可知,负极区放电生成8mol H+有4mol经过质子交换膜进入正极区,所以Pt1电极区增加的H+为4mol,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
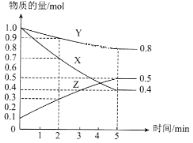
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A.X、Y、Z的反应速率相等 B.容器内气体密度保持不变 C.容器内气体压强保持不变 D.消耗3molX的同时生成1mol Y
③2min内X的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.碳酸氢钠溶液中滴入少量的氢氧化钙溶液:HCO3-+OH-= CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类(填序号)
①O2与O3 ②![]() C与
C与![]() C ③H2O和D2O ④冰与干冰 ⑤H2、D2、T2 ⑥乙醇与乙醚(CH3-O-CH3) ⑦CH3CH2CH2CH2CH3和CH3CH2CH2CH2CH3
C ③H2O和D2O ④冰与干冰 ⑤H2、D2、T2 ⑥乙醇与乙醚(CH3-O-CH3) ⑦CH3CH2CH2CH2CH3和CH3CH2CH2CH2CH3
(1)互为同位素的是___;
(2)互为同素异形体的是___;
(3)互为同分异构体的是___;
(4)属于同一化合物的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
C | 浓硫酸 | 乙醇 | KMnO4 | 发生消去反应生成乙烯 | |
D | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是

A.理论上消耗HCHO和Fe3+的物质的量之比为4:1
B.30gHCHO被氧化时,理论上电路中通过2mol电子
C.电池正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
D.其他条件相同,甲醛浓度越大,所得有色配合物溶液的吸光度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
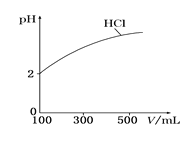
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
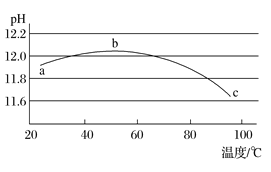
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
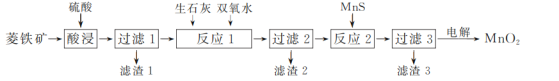
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(3)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl)之比为____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com