
 太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )
太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )| A. | 铁 | B. | 硫 | C. | 硅 | D. | 铜 |
科目:高中化学 来源: 题型:填空题
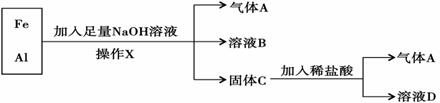
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
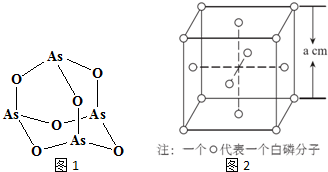
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
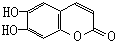 )具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )
)具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚类化合物又可看成酯类化合物 | |
| C. | 能与银氨溶液发生银镜反应 | |
| D. | 1 mol该物质最多与3 mol Br2 发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com