用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,② ,③ ,④移液,⑤ ,⑥ ,⑦摇匀.
(2)所需仪器为:容量瓶(规格: )、托盘天平、还需要哪些玻璃仪器才能完成该实验,请写出: .
使用容量瓶前必须进行的操作是 .
(3)试分析下列操作对所配溶液的浓度有何影响.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶浓度的影响: .
③某同学从该溶液中取出50ml,其中NaCl的物质的量浓度为 .
【答案】
分析:(1)由c=

可知溶液配制原理,所以固体配制溶液的一般步骤为计算,称量,溶解,移液,洗涤移液,定容,摇匀;
(2)一定容积的容量瓶只能配制相应体积的溶液,配制1.00mol/L的NaCl溶液500mL,所以容量瓶的规格为500ml;
根据实验操作步骤,选择所需的仪器;容量瓶使用前必须检查是否漏水;
(3)①②分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
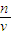
分析判断;
③溶液是均一的,浓度相同.
解答:解:(1)根据溶液配制原理,所以固体配制溶液的一般步骤为计算,称量,溶解,移液,洗涤移液,定容,摇匀,
故答案为:称量;溶解;洗涤;定容;
(2)配制500mL 0.10mol?L
-1的NaCl溶液,所以还需要500ml容量瓶,溶解需要用烧杯、玻璃棒,玻璃棒搅拌,加速溶解;移液需要玻璃棒引流;最后需用胶头滴管定容,
容量瓶使用前必须检查是否漏水,
故答案为:500ml容量瓶;烧杯、玻璃棒、胶头滴管;查漏;
(3)①液体具有热胀冷缩的性质,加热加速溶解,未冷却到室温,配成了溶液,会导致溶液体积偏小,溶液浓度偏高.故答案为:偏高;
②定容后,倒置容量瓶摇匀后平放静置,液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,再加水定容,导致溶液体积偏大,所以溶液浓度偏低,
故答案为:偏低;
③溶液是均一的,溶液中取出50ml,其中NaCl的物质的量浓度不变,为1.00mol/L,故答案为:1.00mol/L.
点评:本题考查溶液的配制,难度不大,关键清楚溶液配制的原理,通过c=
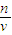
可以加深理解.

 可知溶液配制原理,所以固体配制溶液的一般步骤为计算,称量,溶解,移液,洗涤移液,定容,摇匀;
可知溶液配制原理,所以固体配制溶液的一般步骤为计算,称量,溶解,移液,洗涤移液,定容,摇匀;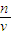 分析判断;
分析判断;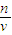 可以加深理解.
可以加深理解. 

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题: 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题