
| A. | 常温下1 L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24 L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
分析 A.根据n=cV计算出硝酸铵的物质的量,再计算出含有N原子的物质的量;
B.浓硫酸与锌反应生成二氧化硫,稀硫酸与锌反应生成氢气,无法计算转移电子数;
C.标况下己烷的状态不是气体;
D.没有告诉在标况下,无法计算生成氢气的体积.
解答 解:A.根据物料守恒可知,无论NH4+怎么水解,溶液中的氮原子为0.2NA个,故A正确;
B.Zn与浓硫酸反应的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,当为稀硫酸时,发生Zn+H2SO4=ZnSO4+H2↑,由上述分析可知放出的气体中除SO2外还有H2,若1mol浓硫酸反应只生成二氧化硫,转移1mol电子,若生成氢气,反应结束时转移电子的物质的量2mol,含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数在1NA-2NA间,故B错误;
C.己烷在标准状况下的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故C错误;
D.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算生成氢气的体积,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件:标准状况下、气体.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 182.7 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | MgCl2所含离子键的强度比NaCl大 | ||
| C. | AlCl3加热能升华 | D. | 单质B是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
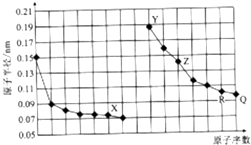
| A. | QX2、RX2都有杀菌消毒的作用,二者常用于自来水消毒 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高氧化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | X元素的最外层电子数为2 | B. | Y的气态氢化物的化学式为HY | ||
| C. | Z的最高价氧化物的化学式为ZO2 | D. | X、Y、Z的单质中X单质最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复合材料一定是由两种或两种以上材料制成的 | |
| B. | 复合材料既保持了原材料的优点,又有优于原材料的特点 | |
| C. | 在复合材料中,增强体起骨架作用 | |
| D. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是胶体可以发生丁达尔现象 | |
| B. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| C. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 硫酸的电离方程式为:H2SO4═2H++SO42- 点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com