
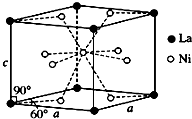
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.分析 (1)①Ti是22号元素,根据原子核外电子排布规律排布;
②Fe是26号元素,原子核外有spd等能级;
(2)①反应式中非金属元素有三种:O、C、Cl,结合化合物CCl4、NaClO中元素化合价判断;
②根据1个单键是1个δ键,1个双键中含有1个δ键,1个π键以及COCl2分子的结构式来解答;
(3)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(4)①根据均摊法计算晶胞中实际含有的原子个数,确定化学式;
②根据一个晶胞的质量m=ρv计算;
③根据储氢能力=$\frac{储氢后氢气的密度}{标准状况下氢气的密度}$计算.
解答 解:(1)①Ti是22号元素,位于元素周期表中第四周期第IVB族,故Ti的基态原子价电子排布式为 3d24s2,故答案为:3d24s2;
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+$\frac{4-1×2-2}{2}$=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1×1+$\frac{1}{2}$×8=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,故答案为:LaNi5;
②一个晶胞的质量m=$\frac{M}{N{\;}_{A}}$,根据m=ρv,即v=$\frac{M}{{{N_A}•d}}$,故答案为:$\frac{M}{{{N_A}•d}}$;
③LaNi5合金储氢后的密度ρ=$\frac{m(晶胞中的H)}{V(晶胞)}$=$\frac{1×6}{{N}_{A}×(511×10{\;}^{-10}){\;}^{2}×sin60°×397×1{0}^{-10}}$=0.111g•cm-3,由定义式可知储氢能力=$\frac{0.111g•cm{\;}^{-3}}{8.98×10{\;}^{-5}g•cm{\;}^{-3}}$≈1236,故答案为:1236.
点评 本题综合性较强,考查了晶胞的计算、化学键、核外电子排布、电离能和电负性的含义及应用,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
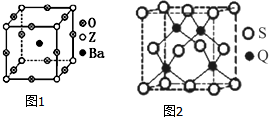 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
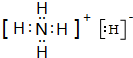 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
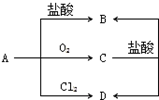 已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:
已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
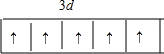 .
. .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
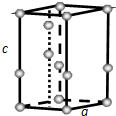
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com