
在密闭容器中进行下列反应:X2(g)+Y2(g)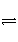
 2Z(g)。已知X2、Y2和Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是( )
2Z(g)。已知X2、Y2和Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是( )
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;该反应的熵ΔS________0(选填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的物质中,属于两性化合物的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.②③ B.②③④
C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为x2-和z-,Y+ 和z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B、单质活泼性: X>Y>Z
C. 原子序数: X>Y>Z D、离子半径: X2—>Y+>Z—
查看答案和解析>>
科目:高中化学 来源: 题型:
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等,其中硫酸最为重要,在工业上有广泛的应用。
完成下列计算:
(1) 浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况),若将反应后的溶液稀释至500mL,该溶液中硫酸铜的物质的量浓度为 mol·L-1;
(2)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)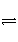
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
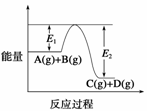
(1)该反应是________反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是______________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?____________,原因是
________________________________________________________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
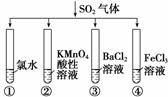
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中无明显现象
D.试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
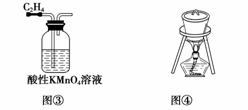
下列实验装置或操作正确的是( )
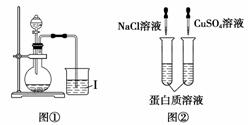
A.图①向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO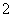
B.图②两支试管中的蛋白质溶液均会变性
C.图③装置用来除去C2H4中的杂质SO2
D.图④装置用来海带灼烧成灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com