
| A. | 标准状况下44.8L乙醇(C2H5OH)含有氢原子数为12NA | |
| B. | 25°C,101KPa条件下,1.4g N2的体积大于1.12L | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和 N2的混合气体含有约3.01×1022个原子 |
分析 A.气体摩尔体积使用对象为气体;
B.25°C,101KPa条件下Vm大于22.4L/mol;
C.摩尔质量单位为g/mol;
D.依据n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$结合一氧化碳、氮气都是双原子分子解答.
解答 解:A.标况下乙醇为液体,不能使用气体摩尔体积,故A错误;
B.25°C,101KPa条件下Vm大于22.4L/mol,1.4g N2的物质的量为:$\frac{1.4g}{28g/mol}$=0.05mol,体积大于1.12L,故B正确;
C.22g某气体含分子数为0.5NA,则其摩尔质量为44g/mol,故C错误;
D.标准状况下1.12L CO和 N2的混合气体含有约$\frac{1.12L}{22.4L/mol}$×2×6.02×1023mol-1=6.02×1023个原子,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意标况下乙醇的状态为液体,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,NA个N2所占的体积约为22.4L | |
| B. | 1L1mol•L-1NaOH水溶液中含有的氧原子数为NA | |
| C. | 足量Na与1molCl2完全反应,转移电子的数目为2NA | |
| D. | 1mol Na2O2中含有的阴离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| B. | 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 | |
| C. | 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 二氧化碳的水溶液能够导电,故二氧化碳属于电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氧化钠在水中的电离方程式可表示为Na2O=2Na++O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
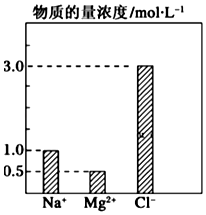 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com