
分析 A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;7.8gB的氢氧化物恰好能与100mL 3mol•L-1盐酸完全反应,则n(H+)=n(OH-),设B的化合价为x,摩尔质量为y,则$\frac{7.8}{17x+y}$×x=0.3,显然x=3,y=27符合,B原子核中质子数比中子数少1个,则B的质子数为13,即B为Al元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,即D为O元素,由此解答.
解答 解:(1)元素氯元素位于第第三周期第ⅦA族、它的最高价氧化物的化学式为Cl2O7,故答案为:三;ⅦA;Cl2O7;
(2)A是钠、B是铝、D是氧,故答案为:钠、铝、氧;
(3)铝与氧形成的化合物的化学式为Al2O3,氧化铝与氢氧化铝反应的离子方程式:Al2O3+2OH-═2 AlO2-+H2O,故答案为:Al2O3,Al2O3+2OH-═2 AlO2-+H2O;(4)氯气与氢氧化钠反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查位置结构性质的关系及应用,利用讨论法确定B元素是解答本题的关键,熟悉掌握元素及其单质、化合物的性质,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
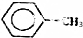 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(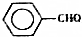 )、苯甲酸(
)、苯甲酸(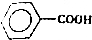 )等产品,下表列出了有关物质的部分物理性质,请回答:
)等产品,下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
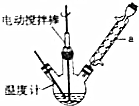
 .此反应的原子利用率理论上可达66.25%.
.此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中氮气、氢气、氨的物质的量保持不变 | |
| B. | 平衡体系中氮气、氢气、氨的浓度保持不变 | |
| C. | 单位时间内生成的氨和分解的氨物质的量相同 | |
| D. | 单位时间内消耗的氮气和氢气与生成的氨气物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
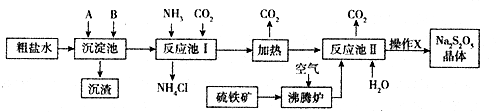
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

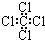
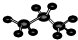
| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
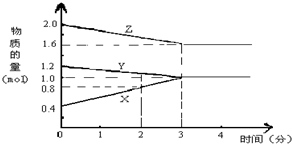
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
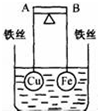 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com