
【题目】根据下图回答问题:
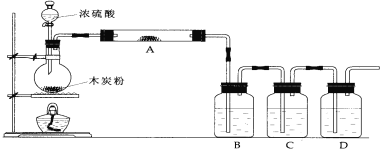
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:__________________
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是_________________作用是________________________.
B中加入的试剂是_________________作用是________________________.
C中加入的试剂是 _________________ ,作用是除尽 ____________气体.
D中加入的试剂是_________________作用是________________________.
(3)实验时,C中应观察到的现象是_______________________.
【答案】2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O 无水硫酸铜 检验H2O 品红溶液 检验SO2 足量酸性KMnO4溶液 SO2(或足量的溴水) 澄清石灰水 检验CO2 导管有气泡冒出;溶液颜色逐渐变浅
CO2↑+2SO2↑+2H2O 无水硫酸铜 检验H2O 品红溶液 检验SO2 足量酸性KMnO4溶液 SO2(或足量的溴水) 澄清石灰水 检验CO2 导管有气泡冒出;溶液颜色逐渐变浅
【解析】
(1)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水;
(2)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,可先用无水硫酸铜检验水,然后用品红检验二氧化硫,用酸性高锰酸钾除去二氧化硫,可用澄清石灰水检验二氧化碳气体;
(3)二氧化硫与酸性高锰酸钾发生氧化还原反应。
(1)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,反应的方程式为2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(2)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,可先用无水硫酸铜检验水,然后用品红检验二氧化硫,用酸性高锰酸钾除去二氧化硫,可用澄清石灰水检验二氧化碳气体,则A中加入无水硫酸铜,目的是检验 H2O,B中加入品红溶液,目的是检验 SO2,C中加入足量酸性KMnO4溶液,目的是除去SO2,D中加入澄清石灰水,目的是检验CO2,
故答案为:无水硫酸铜;检验H2O;品红溶液;检验SO2;足量酸性KMnO4溶液;SO2;
澄清石灰水;检验CO2;
(4)二氧化碳不溶液酸性高锰酸钾,二氧化硫与酸性高锰酸钾发生氧化还原反应,可被还原生成二氧化锰,则可观察到导管有气泡冒出;溶液颜色逐渐变浅,
故答案为:导管有气泡冒出;溶液颜色逐渐变浅。


科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是
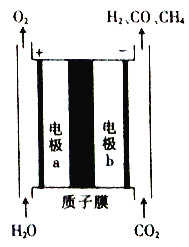
A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物M广泛用于各种刹车片。实验室以烃A为原料制备M的一种合成路线如下:

已知:

回答下列问题:
(1)A的结构简式为____。H的化学名称为_____。
(2)B的分子式为____。C中官能团的名称为____。
(3)由D生成E、由F生成G的反应类型分别为____、_____。
(4)由G和I生成M的化学方程式为____。
(5)Q为I的同分异构体,同时满足下列条件的Q的结构简式为____。
①1 moi Q最多消耗4 mol NaOH ②核磁共振氢谱有4组吸收峰
(6)参照上述合成路线和信息,以甲苯为原料(无机试剂任选),设计制备![]() 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构和性质的说法正确的是( )
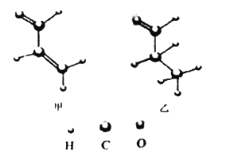

A. 甲中所有原子可能处于同一平面
B. 乙的一氯代物有4种
C. 丙一定条件下能发生的反应类型有取代,加成,氧化,消去反应
D. 丁与苯互为等电子体,可由苯的结构和性质推测丁的结构与性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。

(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
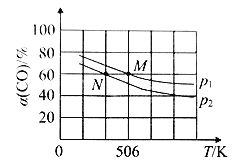
P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)===2NO2(g)△H=-110kJ·mol-1;25℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kpa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是____。用压强代替浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为____(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g)=2NO2(g)有如下两步历程
第一步2NO(g)====N2O2(g) 快速反应
第二步N2O2(g)+O2(g)=2NO2(g) 慢反应
总反应速率主要由第______步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强p∞(35℃)______p∞(25℃)(填“大于”、“等于”或“小于”)。
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)===N2(g)+2H2O(g);△H=a;已知在标准状况,由元素最稳定的单质生成1mol纯化合物时的焓变叫标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJ/mol、-280kJ/mol,则a=_____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2,则悬浮液吸收NO2的化学方程式为__________;CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率。请用平衡移动原理解释其主要原因_________________(结合化学用语和文字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
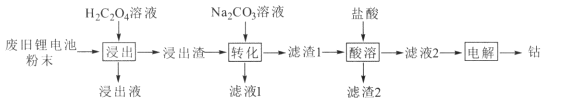
已知:Ksp(CoC2O4)=2.5×10-9,Ksp(CoCO3)=1.5×10-13
回答下列问题:
(1)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为 _______ ,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(2)“转化”中加入Na2CO3溶液发生反应的离子方程式为___________,该反应进行的程度较大,试用平衡常数K解释原因 _____ 。
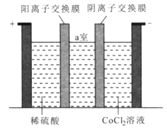
(3)“电解”时装置如图所示。阳极的电极反应式为______,电解后a室中的电解液可返回 ________工序继续使用。
(4)某废旧锂电池粉末中LiCoO2的质量分数为w,将mkg该废料进行回收利用,电解得到钴nkg,钴的回收率为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com