
| HCl |
| 实验 序号 | 初始浓度 c/mol?L-1 | 溴颜色消失 所需时间 t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.8 | 0.2 | 0.001 | 290 |
| ② | 1.6 | 0.2 | 0.001 | 145 |
| ③ | 0.8 | 0.4 | 0.001 | 145 |
| ④ | 0.8 | 0.2 | 0.001 | 580 |
| A、v (Br2)与c(CH3COCH3)成正比 |
| B、增大c(Br2),v (Br2)变小 |
| C、增大c(HCl),v (Br2)增大 |
| D、实验②和③的v (Br2)相等 |


科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g O2所含的原子数目为NA |
| B、1 mol氢约含有6.02×1023个微粒 |
| C、标准状况下,2NA 个H2O的体积约为44.8 L |
| D、标准状况下,22.4 L CH4和H2的混合气体中含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离过程是吸热过程 |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离度α(25℃)>α(35℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:
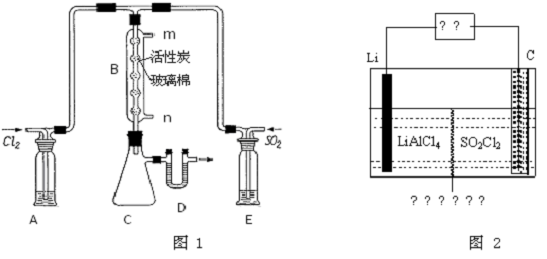
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com