
【题目】已知反应:①Fe+H2SO4(稀)=FeSO4+H2↑;②Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中_______(填元素符号,下同)被氧化,还原产物为_____;反应②中______做还原剂,_____元素被还原。
(2)当反应①中生成2 g H2时,消耗H2SO4的质量是_____________ g。
(3)当反应②中生成32 g SO2时,消耗H2SO4的质量是_________ ,其中有_________ g H2SO4被还原。
【答案】Fe H2 Cu S 98 98 g 49
【解析】
(1)反应①中Fe元素化合价升高,被氧化,H元素化合价降低,被还原;反应②S元素化合价由+6价降低到+4价,被还原,Cu元素化合价升高;
(2)计算2g H2的物质的量,结合方程式计算消耗H2SO4的质量;
(3)反应②S元素化合价由+6价降低到+4价,被还原,以此解答该题.
(1)反应①中Fe元素化合价升高,被氧化,H元素化合价降低,被还原,还原产物为H2,反应②S元素化合价由+6价降低到+4价,被还原,Cu元素化合价升高,被氧化,Cu为还原剂,故答案为:Fe;H2;Cu;S;
(2)2gH2的物质的量为1mol,由方程式可知消耗1mol硫酸,H2SO4的质量为98g,故答案为:98;
(3)反应②S元素化合价由+6价降低到+4价,被还原,n(SO2)=32g64g/mol=0.5mol,转移电子0.5mol×(64)=1mol,由方程式可知消耗1mol硫酸,质量为98g,其中有49gH2SO4被还原,故答案为:98;49;


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】某含铜化合物的化学式为Cux(OH)y(CO3)z(Cu为+2价)。取该样品22.2 g,充分加热后,得到黑色固体氧化铜16.0 g,则该物质的化学式为
A.Cu2(OH)4CO3B.Cu3(OH)4CO3
C.Cu2(OH)2CO3D.Cu4(OH)2(CO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)《2017年江苏省政府工作报告》提出“深度参与‘一带一路’建设,全面实施国际产能合作三年行动计划”。
①畅通信息丝绸之路,需要规划建设洲际海底光缆项目。生产光缆所用的光导纤维属于_______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②沪通铁路的建成将江苏沿海进一步融入上海都市圈。金属防腐是铁路建设的重要课题,下列做法的目的不是为了防腐的是_______(填字母)。
a.将钢轨打磨 b.将钢轨涂刷沥青 c.将钢轨与铝连接
③“一带一路”建设需要用大量水泥。生产水泥的主要原料为石灰石和_______(填字母)。
a.纯碱 b.石英 c.黏土
(2)芦蒿是江苏人喜爱的食材,每100g嫩茎中含有蛋白质3.6g、钙730mg、铁2.8mg、胡萝卜素1.4mg、维生素C 49mg等。

①芦蒿中属于微量元素的是_______,还缺少的给人体提供能量的营养素是________。
②β—胡萝卜素在食品工业常用作__________。
③每100g上述芦蒿嫩茎中含有的蛋白质完全水解,所得氨基酸的总质量________3.6g(填“>”、“<”或“=”)。
④维生素C能防治坏血病,又称为抗坏血酸。在维生素C溶液中滴入少量__________,可观察到溶液蓝色褪去,说明维生素C具有还原性。
(3)健康江苏2030规划纲要明确要求“实施最严格的环境保护制度,切实解决影响人民群众健康的突出环境问题”。
①下图为2017年除夕至初一全国部分城市PM2.5小时值浓度变化图。空气质量最好的城市是_________,原因是采取了烟花爆竹禁放措施;燃放烟花爆竹还会释放出大量的SO2等有害气体,写出SO2在空气中形成硫酸型酸雨的总化学方程式:___________________________。
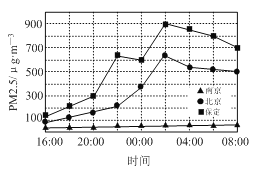
②家庭生活要注意防止和减少对环境的污染。家居装修时要选择优质胶合板,原因是防止___________(填物质名称)产生污染;用过的聚乙烯塑料食品袋要投入贴有_________标志的垃圾箱中。
③对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。环境专家认为可以用金属镁将水体中的NO3-还原为N2,此时所得溶液呈碱性。该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备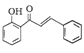 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氯、溴、碘等元素,其中溴和碘在陆地上含量极少,主要存在于海水中。
(1)氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)写出有关的化学方程式_________________________________。
(2)亚氯酸钠(NaClO2)是一种漂白剂。 已知NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________________________________________。
(3)从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。氧化时常用氯气做氧化剂,写出有关的离子方程式___________________________________________________________。海带提碘时,由于碘的量较少,在灼烧、溶解之后得到的溶液用硝酸银溶液很难检验。设计一个检验溶液中是否含有碘离子的方法_________________________________________。
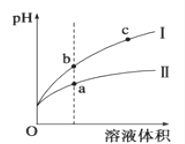
(4)盐酸和醋酿都是一元酸,某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如下图所示。据图判断盐酸稀释时的pH变化曲线为___________ (填“I”或“II”),溶液的导电性b ___________ c(填“>”、“<”或“=”)。水电离的c(H+)a点比b点大还是小?从电离平衡移动原理解释原因________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种晶体,用序号回答下列问题:
A.水晶 B.白磷 C.冰醋酸 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)含有非极性键的原子晶体是_________ ,属于原子晶体的化合物是_______,不含化学键的分子晶体是 _______,属于分子晶体的单质是_________
(2)含有离子键、共价键、配位键的化合物是___________,受热熔化,需克服共价键的是___________.
(3)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有_____个硅原子,______个碳原子;金刚石熔点高于金刚砂的原因_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Se3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Se3+、Zn2+的水合离子为无色的原因为_______________________。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为_____________________。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为_________,配位数为__________________。
(6)若梓原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为______g/㎝3 (用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中用途广泛。回答下列问题:
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是______(填序号)。
A.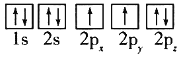
B.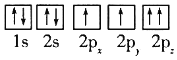
C.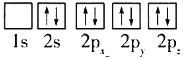
D.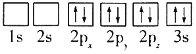
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如下图所示的离子。
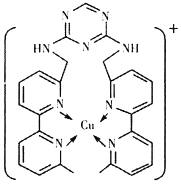
①该离子中含有化学键的类型有______(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
②该离子中碳原子的杂化方式有______。
③H、N、Cu三种元素的电负性由大到小的顺序是______。
(3)甲醇(CH3OH)在Cu催化作用下被氧化成甲醛(HCHO)。甲醛分子内σ键与π键个数之比为______。甲醇分子内的O-C-H键角______(填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
(4)某磷青铜晶胞结构如下图所示:
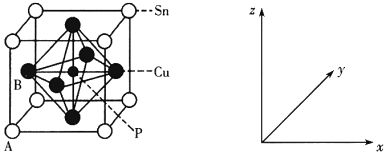
①其中原子坐标参数A为(0,0,0);B为(0,![]() ,
,![]() )。则P原子的坐标参数为______。
)。则P原子的坐标参数为______。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为______。
③若晶体密度为agcm3,最近的Cu原子核间距为______pm(用含NA和a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com