

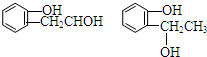 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.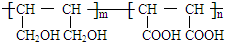 .
.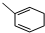 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
. 分析 Ⅰ与溴水发生1,4-加成所生产的Ⅳ为CH2BrCH=CHCH2Br,Ⅳ在氢氧化钠水溶液、加热条件下发生水解反应生成Ⅴ为HOCH2CH=CHCH2OH,V发生氧化反应生成Ⅱ,化合物Ⅱ与新制氢氧化铜溶液、酸化得到Ⅵ,则醛基转化为羧基,则Ⅵ为HOOCCH=CHCOOH;
(3)化合物Ⅲ对应的同分异构体反应:①遇FeCl3溶液显紫色,说明含有酚羟基;②在浓硫酸催化作用下能发生消去反应,含有醇羟基,较好Ⅲ的结构可知,侧链为-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有邻、间、对三种;
(4)化合物Ⅴ和化合物Ⅵ在一定条件下按物质的量m:n反应合成高分子化合物Ⅶ,且原子转化率为100%,说明发生加聚反应;
(5) 能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂,
能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂, 的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式.
的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式.
解答 解:Ⅰ与溴水发生1,4-加成所生产的Ⅳ为CH2BrCH=CHCH2Br,Ⅳ在氢氧化钠水溶液、加热条件下发生水解反应生成Ⅴ为HOCH2CH=CHCH2OH,V发生氧化反应生成Ⅱ,化合物Ⅱ与新制氢氧化铜溶液、酸化得到Ⅵ,则醛基转化为羧基,则Ⅵ为HOOCCH=CHCOOH.
(1)由结构简式可知化合物Ⅲ的化学式为C8H10O2,碳碳双键与醛基均氢气发生加成反应,故l mol化合物Ⅲ最多能与3mol H2发生加成反应,
故答案为:C8H10O2;3;
(2))Ⅳ→Ⅴ是卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,反应方程式为:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr,
故答案为:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr;
(3)化合物Ⅲ对应的同分异构体反应:①遇FeCl3溶液显紫色,说明含有酚羟基;②在浓硫酸催化作用下能发生消去反应,含有醇羟基,较好Ⅲ的结构可知,侧链为-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有邻、间、对三种,共有6种,其中任意一种为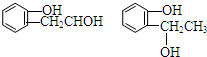 等,
等,
故答案为:6;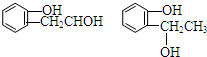 等;
等;
(4)化合物Ⅴ和化合物Ⅵ在一定条件下按物质的量m:n反应合成高分子化合物Ⅶ,且原子转化率为100%,说明发生加聚反应,生成物结构简式为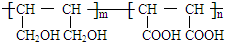 ,
,
故答案为: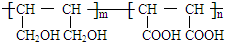 ;
;
(5) 能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂,
能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂, 的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式Ⅷ的一种结构简式为:
的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式Ⅷ的一种结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、同分异构体书写等,需要学生熟练掌握官能团的结构、性质以及相互转化,较好的考查学生自学能力、知识迁移运用能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化合物M的分子式为C14H15NO7 | |
| B. | 化合物M能使酸性KMnO4溶液褪色 | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 1mol在NaOH溶液中反应,最多消耗4molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com